Ung thư thực quản (EC) là một vấn đề sức khỏe toàn cầu quan trọng và liệu pháp miễn dịch hứa hẹn có thể điều trị căn bệnh này. Tuy nhiên, tình trạng kháng liệu pháp miễn dịch có thể xảy ra và thường liên quan đến vi môi trường miễn dịch của khối u (TIME).
Bài viết được viết bởi ThS. BS Mai Viễn Phương - Trưởng đơn nguyên Nội soi tiêu hóa - Khoa Khám bệnh & Nội khoa - Bệnh viện Đa khoa Quốc tế Vinmec Central Park.
Việc hiểu TIME, đặc biệt là TIME ức chế, là rất quan trọng. Mục đích của bài đánh giá này là làm sáng tỏ các cơ chế cơ bản của TIME ức chế trong EC, bao gồm thâm nhiễm tế bào, phân nhóm tế bào miễn dịch, cytokine và các con đường truyền tín hiệu, cũng như biểu hiện giảm của các phân tử phức hợp tương hợp mô chính trong tế bào khối u. Tóm tắt này có thể giúp dự đoán phản ứng của bệnh nhân EC đối với liệu pháp miễn dịch và tạo điều kiện cho các phương pháp điều trị được cá nhân hóa để tối ưu hóa kết quả miễn dịch.
Rối loạn chức năng tế bào lympho T trong vi môi trường miễn dịch khối u ung thư thực quản
Tế bào lympho T
Tế bào T là thành phần chính của các tế bào miễn dịch thâm nhiễm trong hầu hết các khối u rắn, và tế bào T gây độc tế bào CD8 + (CTL) và tế bào hỗ trợ T CD4 + (Ths) đóng vai trò quan trọng trong việc loại bỏ các tế bào khối u. Cụ thể, CTL hoạt động có thể gây ra tác dụng gây độc tế bào đối với các tế bào khối u bằng cách giải phóng các chất gây độc tế bào, và Ths có thể thúc đẩy hoặc ngăn chặn các hoạt động miễn dịch của vật chủ nhắm vào các tế bào khối u.
Theo kết quả giải trình tự tế bào đơn, tỷ lệ tế bào T CD8 + cạn kiệt dương tính với phối tử chemokine mô típ CXC 13 (CXCL13) tăng lên, vì các tế bào này là loại tế bào T chính trong TME của bệnh nhân EAC. Ở ESCC, sự thâm nhiễm và tăng sinh của các dòng tế bào T cũng đã được quan sát thấy, và cụm tế bào T CD8 + cạn kiệt (CD8-C7-TIGIT) và các cụm CD8-C5-CCL5 và CD8-C6-STMN1 cạn kiệt trước chiếm tỷ lệ cao trong các cụm tế bào T CD8 +. Mức độ biểu hiện của ligase ubiquitin E3 MARCH7 trong các mô ESCC đã được chứng minh là lớn hơn đáng kể so với mô không có khối u và có tương quan tiêu cực với các tế bào miễn dịch xâm nhập khối u, chẳng hạn như tế bào T CD8 + .
Điểm kiểm soát miễn dịch
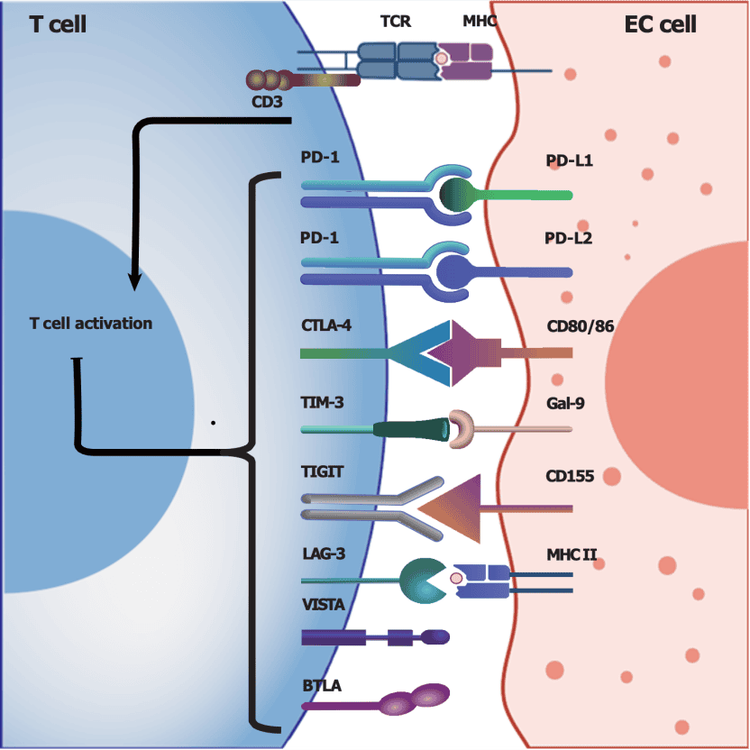
Tế bào T hoạt hóa có thể biểu hiện nhiều thụ thể ức chế khác nhau, được gọi là điểm kiểm soát miễn dịch, để ngăn ngừa phản ứng miễn dịch quá mức, nhằm duy trì sự cân bằng miễn dịch; tuy nhiên, các tế bào khối u có thể khai thác các điểm kiểm soát này để tạo ra các tín hiệu ức chế đồng thời trong TME và tạo ra TME ức chế miễn dịch, đóng vai trò quan trọng trong việc thoát khỏi hệ thống miễn dịch của khối u. Do đó, các loại thuốc như thuốc ức chế điểm kiểm soát miễn dịch đã được nghiên cứu về khả năng chặn các điểm kiểm soát này, sau đó tăng cường khả năng của hệ thống miễn dịch trong việc tấn công các tế bào khối u.
Protein chết tế bào theo chương trình 1 (PD-1), được biểu hiện trên màng tế bào T, là một điểm kiểm tra miễn dịch cổ điển có thể truyền tín hiệu ức chế miễn dịch khi nó tương tác với phối tử tương ứng của nó là phối tử chết tế bào theo chương trình 1 (PD-L1), được biểu hiện trên tế bào khối u. Những tương tác này có thể ức chế các hoạt động gây độc tế bào của tế bào T và cho phép các tế bào khối u thoát khỏi sự giám sát và tấn công của hệ miễn dịch, giải thích cho một trong những cơ chế thoát khỏi hệ miễn dịch của khối u. Ví dụ, bệnh nhân EC có biểu hiện PD-L1/PD-L2 cao, đặc biệt là những bệnh nhân ở giai đoạn tiến triển, có thể có tiên lượng xấu. Do đó, ức chế PD-1/PD-L1 bằng cách chặn tương tác của chúng có thể khôi phục sức sống và độc tính của tế bào T trong TIME. Trong những năm gần đây, liệu pháp miễn dịch liên quan đến việc chặn điểm kiểm tra nhắm vào PD-1/PD-L1 đã phát triển nhanh chóng, trở thành phương pháp điều trị đầu tay cho nhiều loại ung thư, nhưng hiệu quả của việc chặn PD-1/PD-L1 phần lớn phụ thuộc vào mức độ biểu hiện của PD-1/PD-L1 trong TME
Sự tương tác giữa CD28 trên tế bào T và B7-1 (CD80)/B7-2 (CD86) trên tế bào trình diện kháng nguyên hoặc tế bào đích có thể cung cấp tín hiệu kích hoạt đồng kích thích cho tế bào T và sau đó thúc đẩy hoạt hóa tế bào T. Kháng nguyên liên quan đến tế bào lympho T ly giải tế bào-4 (CTLA-4), một phân tử điều hòa quan trọng khác chủ yếu được biểu hiện trên tế bào T điều hòa (Treg) và tế bào T hoạt hóa, có thể liên kết cạnh tranh với B7 và ức chế quá trình truyền tín hiệu tế bào để hoạt hóa tế bào T, sau đó ức chế phản ứng miễn dịch. Do đó, CTLA-4 cũng được coi là một phân tử điểm kiểm tra miễn dịch và việc phong tỏa CTLA-4 có thể tăng cường hiệu quả phản ứng miễn dịch chống lại các tế bào khối u. Tuy nhiên, hiệu quả và tính an toàn của việc phong tỏa CTLA-4 ở bệnh nhân EC cần được nghiên cứu thêm do số lượng thử nghiệm lâm sàng liên quan còn hạn chế.
Tế bào lympho T điều hòa
Treg là tế bào T CD4 + CD25 + Foxp3 + đóng vai trò quan trọng trong việc ức chế phản ứng miễn dịch của vật chủ trong TME. Sự thâm nhiễm Treg có thể tương quan với sự xâm lấn khối u, tiến triển, di căn và khả năng sống sót kém sau hóa trị liệu và sự thâm nhiễm Treg cũng đã được chứng minh là có tương quan tiêu cực với các tế bào hiệu ứng chống khối u như tế bào CTL và tế bào NK trong ESCC. Ngoài ra, chemokine CCL20 do giảm methyl hóa gây ra trong TIME có thể ảnh hưởng đến sự cân bằng miễn dịch và thúc đẩy sự tiến triển của EC, có thể góp phần vào sự thâm nhiễm Treg trong ESCC. Hơn nữa, Han và cộng sự đã chỉ ra rằng Treg có thể có biểu hiện interleukin (IL)-32 cao nhất trong TME của bệnh nhân ESCC và biểu hiện này có tương quan tích cực với Foxp3, có khả năng thúc đẩy sự tiến triển của khối u; ngoài ra, IL-32 cũng có thể gây ra sự tiết interferon (IFN)-γ bởi tế bào T CD8 + và tạo điều kiện cho khả năng miễn dịch chống khối u. Ngoài ra, sự mất cân bằng trong tế bào Th17/Treg cũng được báo cáo là xảy ra trong quá trình phát triển thực quản Barrett, tiền thân của EAC, thông qua việc điều chỉnh việc giải phóng một số cytokine gây viêm.
Tế bào lympho NK
Tế bào NK là một loại tế bào lympho tiêu diệt tế bào khối u khác đã thu hút được sự chú ý đáng kể trong liệu pháp miễn dịch ung thư. Các nghiên cứu tiền lâm sàng và lâm sàng trước đây đã cho thấy kết quả khả quan đối với liệu pháp miễn dịch liên quan đến tế bào NK và cung cấp một góc nhìn mới về các chiến lược miễn dịch trị liệu cho các phương pháp điều trị liên quan đến tế bào NK. Tuy nhiên, tế bào NK thường bị giảm hoặc cạn kiệt TME ức chế miễn dịch tương tự như tế bào T, điều này cũng có thể hạn chế tác dụng chống khối u của chúng.
Số lượng tế bào NK đã được chứng minh là thấp hơn đáng kể trong các mô ESCC so với các mô không phải khối u lân cận; ngoài ra, một phân nhóm tế bào cụ thể, NK-C3-KLRC1 đã được chứng minh là phân biệt với NK-C1-NCR3, và số lượng tế bào NK-C2-STMN1 đã tăng đáng kể trong ESCC. Phân nhóm NK-C1-NCR3 đã được chứng minh là biểu hiện mức độ tương đối cao của NCR3, CD266, NKG7 và LAMP1, và các phân nhóm NK-C3-KLRC1 và NK-C2-STMN1 đã được chứng minh là biểu hiện mức độ tương đối cao của KLRC1 và ITGA1[ 22 ]. Là một thụ thể bề mặt tế bào chủ yếu được biểu hiện trên tế bào NK và một số loại tế bào T, thành viên nhóm NK 2 D (NKG2D) có thể tương tác với các phối tử của nó (NKG2DL) để kích hoạt tế bào NK và tế bào T, sau đó tăng cường giám sát miễn dịch và thanh thải tế bào khối u hoặc tế bào bị nhiễm bệnh. Các nhà nghiên cứu đã chỉ ra rằng biểu hiện của NKG2DL cao hơn đáng kể ở các mô ESCC so với mô đối chứng và các tế bào ESCC biểu hiện NKG2DL tăng lên, do đó cung cấp một mục tiêu điều trị tiềm năng cho ESCC thông qua việc sử dụng tế bào NK.
Hơn nữa, nhiều cytokine cũng có thể tham gia vào việc điều chỉnh hoạt hóa miễn dịch của tế bào NK. Ví dụ, yếu tố tăng trưởng chuyển dạng (TGF)-β góp phần một phần vào việc điều hòa giảm biểu hiện CD16 trên tế bào NK, dẫn đến suy giảm chức năng tế bào NK. Việc thiếu IL-18 trong các mô ESCC có thể gây ra sản xuất IFN-γ trong tế bào NK và tế bào T CD8 + , và có khả năng thúc đẩy quá trình thanh thải tế bào khối u ung thư thực quản và cải thiện TME ở những bệnh nhân mắc EC. Mức độ biểu hiện của IL-6, một cytokine quan trọng do tế bào ESCC tiết ra trong TME, đã được chứng minh là cao hơn trong các mô khối u và lưu thông máu ở bệnh nhân ESCC, và có thể điều chỉnh tăng đáng kể biểu hiện của CD39 trên tế bào NK và làm suy yếu chức năng của tế bào NK, cũng như liên quan đến tiên lượng xấu của bệnh nhân ESCC.
Tài liệu tham khảo
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71:209-249
2. Siewert JR, Ott K. Are squamous and adenocarcinomas of the esophagus the same disease? Semin Radiat Oncol. 2007;17:38-44.
3. Zhang XJ, Yu Y, Zhao HP, Guo L, Dai K, Lv J. Mechanisms of tumor immunosuppressive microenvironment formation in esophageal cancer. World J Gastroenterol 2024; 30(16): 2195-2208.