Thuốc ức chế điểm kiểm soát miễn dịch (ICI) được sử dụng rộng rãi do hiệu quả của chúng trong điều trị nhiều loại khối u. Các biến cố bất lợi liên quan đến miễn dịch (irAE) được định nghĩa là các tác dụng bất lợi do điều trị thuốc ức chế điểm kiểm soát miễn dịch gây ra.
Bài viết được viết bởi ThS. BS Mai Viễn Phương - Trưởng đơn nguyên Nội soi tiêu hóa - Khoa Khám bệnh & Nội khoa - Bệnh viện Đa khoa Quốc tế Vinmec Central Park.
Các triệu chứng lâm sàng của viêm dạ dày liên quan đến ICI rất đa dạng; chúng có thể bị che lấp bởi tác dụng chậm trễ hoặc tích lũy của các phác đồ điều trị trước đó hoặc có thể bị bỏ qua khi cùng tồn tại với các độc tính khác ở đường tiêu hóa dưới, khiến cho việc chẩn đoán trở nên khó khăn. Buồn nôn/nôn và đau bụng thường gặp nhất ở những bệnh nhân bị viêm dạ dày liên quan đến ICI.
Vai trò của các xét nghiệm chẩn đoán
Kết quả xét nghiệm trong phòng thí nghiệm đối với hầu hết bệnh nhân không có ý nghĩa lâm sàng, hoặc họ bị thiếu máu nhẹ và suy dinh dưỡng. Protein phản ứng C (CRP) tăng cao được quan sát thấy ở một số bệnh nhân, nhưng số lượng WBC của họ nằm trong giới hạn bình thường. Tuy nhiên, trong hai trường hợp được báo cáo, những bệnh nhân bị tăng bạch cầu ái toan nặng và tăng nồng độ IgE và IL-5 cho thấy thâm nhiễm bạch cầu ái toan trên mô học. Một số dấu ấn sinh học huyết thanh đã được chứng minh là có thể dự đoán viêm đại tràng liên quan đến ICI. Nồng độ IL-17 trong huyết thanh tăng ở mức cơ bản với mức tăng theo cấp số nhân sau sáu tuần là một chỉ báo tốt cho tiêu chảy/viêm đại tràng do ICI, và nồng độ IL-17 trong huyết thanh giảm tương quan với việc giải quyết các triệu chứng, khiến nó trở thành một chỉ báo có giá trị về đáp ứng điều trị. Nồng độ sCTLA-4 trong huyết thanh cao có thể dự đoán kết quả lâm sàng thuận lợi và nguy cơ irAE cao hơn ở những bệnh nhân MM được điều trị bằng ipilimumab. Hiện tại, không có chỉ số cụ thể nào chứng minh viêm dạ dày liên quan đến ICI ở giai đoạn đầu.
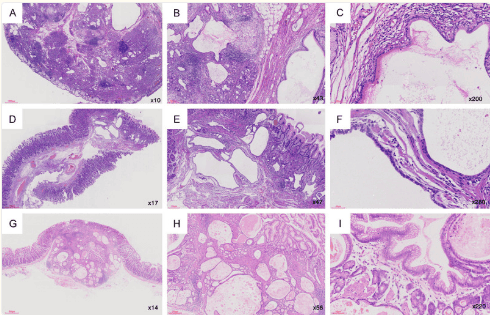
Chụp cắt lớp vi tính (CT) bụng thường không có gì đáng chú ý, chỉ một số ít bệnh nhân có biểu hiện dày thành dạ dày. PET-CT có thể phát hiện sự tích tụ fluorodeoxyglucose lan tỏa trong thành dạ dày, nhưng khó phân biệt với di căn. Nội soi thực quản-dạ dày-tá tràng (nội soi thực quản dạ dày) có thể phát hiện viêm dạ dày, viêm tá tràng [thường không có nhiễm vi khuẩn Helicobacter pylori ( H. pylori )], loét thực quản hoặc dạ dày, viêm hồi tràng hoặc viêm ruột kết. Sung huyết (64%-88%) và phù nề (46%-52%) niêm mạc dạ dày là những phát hiện điển hình khi nội soi thực quản dạ dày. Ở những bệnh nhân bị viêm dạ dày do ICI độ 3, niêm mạc xuất huyết và dễ vỡ, xói mòn dạng mạng lưới hoặc loét ở hang vị cũng đã được quan sát thấy. Tuy nhiên, xét nghiệm mô học hoặc siêu âm nội soi có thể cho thấy các đặc điểm nổi bật của viêm dạ dày tự miễn, mặc dù không có đặc điểm nội soi dạ dày hoặc triệu chứng lâm sàng điển hình.

Mối tương quan giữa các hình ảnh nội soi dạ dày và mô học trong viêm dạ dày do chất ức chế điểm kiểm soát miễn dịch
Một số báo cáo đã chỉ ra mối tương quan yếu giữa các phát hiện nội soi dạ dày và mô học trong viêm dạ dày do PD-1 gây ra. Khoảng 10% -20% bệnh nhân có mô dạ dày bình thường khi nội soi mặc dù viêm dạ dày liên quan đến ICI đã được chứng minh bằng sinh thiết. Do đó, ở những bệnh nhân nghi ngờ viêm dạ dày do PD-1, cần phải tiến hành kiểm tra toàn diện để chẩn đoán, đặc biệt là sinh thiết dạ dày. Hơn nữa, những bệnh nhân bị viêm dạ dày liên quan đến ICI riêng lẻ có xu hướng viêm dạ dày nghiêm trọng hơn khi nội soi (xói mòn/loét/ban đỏ nặng so với ban đỏ nhẹ/bình thường) so với những bệnh nhân bị viêm ruột/viêm đại tràng đồng thời ( P = 0,12).
Sinh thiết dạ dày ở những bệnh nhân có tổn thương nội soi thường cho thấy các biểu hiện bệnh lý mô học của viêm dạ dày hoạt động hoặc viêm toàn dạ dày hoạt động mãn tính. Sự thâm nhiễm lymphoplasmacytic và hạt với bạch cầu ái toan rải rác trong lớp niêm mạc và biểu mô, tình trạng viêm lan tỏa và áp xe hốc thường được quan sát thấy. Phân tích miễn dịch mô hóa học tiếp theo chứng minh rằng các tế bào lympho thâm nhiễm có kết quả dương tính với CD3, với CD8+ chiếm ưu thế hơn CD4+ nhưng âm tính với CD20 và PD-L1 có kết quả dương tính trong các tế bào miễn dịch và/hoặc tế bào biểu mô. Sự liên quan của các vùng giới hạn của đường tiêu hóa, chẳng hạn như tá tràng, dạ dày, hồi tràng hoặc đại tràng, cho thấy một cơ chế miễn dịch tiềm ẩn hướng đến các epitope đặc hiệu cho vị trí này.
Chẩn đoán phân biệt về mặt xét nghiệm
Viêm dạ dày tự miễn hoặc viêm dạ dày giống tự miễn do ICI cần được phân biệt. Giảm đáng kể các tế bào tiết axit và phá hủy các tuyến trong bối cảnh thâm nhiễm lymphoplasmacytic lan tỏa là những biểu hiện điển hình của viêm dạ dày tự miễn dưới nội soi thực quản dạ dày. Ngoài ra, máu ngoại vi dương tính với kháng thể tế bào B, đi kèm với thiếu máu ác tính. Viêm dạ dày miễn dịch liên quan đến ICI cũng cần được phân biệt với viêm dạ dày do H. pylori và viêm dạ dày do cytomegalovirus. Không giống như viêm dạ dày liên quan đến ICI, viêm dạ dày do H. pylori được đặc trưng bởi số lượng tế bào lympho nội mô thấp hơn đáng kể, viêm lớp niêm mạc nhiều hơn và nhiều tập hợp lymphoid hơn. Tuy nhiên, phân tích kiểu hình tế bào lympho của viêm dạ dày do H. pylori và viêm dạ dày nivolumab không cho thấy sự khác biệt về số lượng tế bào CD4+ hoặc tế bào CD8+ của lớp niêm mạc. Xét nghiệm hơi thở C-13 hoặc C-14 là phương pháp không xâm lấn để phân biệt nhiễm trùng H. pylori.
Viêm dạ dày do Cytomegalovirus (CMV) sau liệu pháp miễn dịch đã được báo cáo và một thể vùi CMV bên trong tế bào chất là một dấu hiệu đặc trưng. Đáng chú ý, viêm dạ dày tự miễn có thể đồng thời với nhiễm H. pylori và/hoặc CMV. Đối với những bệnh nhân mà viêm dạ dày do H. pylori và viêm dạ dày do CMV ban đầu đã được loại trừ nhưng các triệu chứng trở nên tồi tệ hơn sau liệu pháp steroid, nên thực hiện một nội soi thực quản dạ dày khác để loại trừ nhiễm H. pylori hoặc CMV cơ hội. Ngoài ra, di căn dạ dày có thể được nhìn thấy dưới dạng xuất huyết, loét và niêm mạc mỏng manh, cần được phân biệt với viêm dạ dày và sinh thiết bệnh lý để tìm tế bào khối u rất phù hợp để xác định.
Tài liệu tham khảo
1. Yamada K, Sawada T, et al. Clinical characteristics of gastrointestinal immune-related adverse events of immune checkpoint inhibitors and their association with survival. World J Gastroenterol. 2021;27:7190-7206
2. Thapa B, Roopkumar J, Kim AS, Gervaso L, Patil PD, Calabrese C, Khorana AA, Funchain P. Incidence and clinical pattern of immune related adverse effects (irAE) due to immune checkpoint inhibitors (ICI). J Clin Oncol. 2019;37:e14151-e14151.
3. Lin J, Lin ZQ, Zheng SC, Chen Y. Immune checkpoint inhibitor-associated gastritis: Patterns and management. World J Gastroenterol 2024; 30(14): 1941-1948