Ung thư thực quản (EC) chiếm 3,1% trong tổng số các trường hợp ung thư mới và đứng thứ tám về tỷ lệ mắc trong số tất cả các loại ung thư; tuy nhiên, ung thư thực quản chiếm 5,5% trong tổng số các ca tử vong liên quan đến ung thư và đứng thứ sáu về tỷ lệ tử vong.
Bài viết được viết bởi ThS. BS Mai Viễn Phương - Trưởng đơn nguyên Nội soi tiêu hóa - Khoa Khám bệnh & Nội khoa - Bệnh viện Đa khoa Quốc tế Vinmec Central Park.
Có hai loại mô học chính của ung thư thực quản: Ung thư biểu mô tế bào vảy thực quản (ESCC) và ung thư biểu mô tuyến thực quản (EAC). Là một khối u ác tính có tính xâm lấn cao, ung thư thực quản (ung thư thực quản) là một vấn đề sức khỏe toàn cầu và là loại ung thư phổ biến thứ tám và là nguyên nhân gây tử vong do ung thư đứng thứ sáu trên toàn thế giới vào năm 2020. Do bản chất sinh miễn dịch cao, các phương pháp tiếp cận liệu pháp miễn dịch mới nổi, chẳng hạn như phong tỏa điểm kiểm soát miễn dịch, đã chứng minh hiệu quả đầy hứa hẹn trong điều trị ung thư thực quản; tuy nhiên, vẫn còn tồn tại một số hạn chế và thách thức nhất định
Những thay đổi trong tế bào ung thư - vi môi trường ung thư thực quản (TIME)
Sự phát triển của ung thư có liên quan chặt chẽ đến sự tích tụ các đột biến gen và các nhà nghiên cứu đã tập trung vào những thay đổi trong tế bào ung thư trong một thời gian khá dài. Gần đây, vi môi trường khối u (TIME) đã trở thành một chủ đề nóng và việc điều chỉnh các tế bào miễn dịch trong TIME đã thu hút được nhiều sự chú ý.
Hệ thống miễn dịch có thể nhận ra và loại bỏ các tế bào khối u biểu hiện các kháng nguyên cụ thể, một quá trình được gọi là giám sát miễn dịch ung thư; trong khi đó, các tế bào ung thư có thể thoát khỏi hoặc ngăn chặn các cuộc tấn công từ hệ thống miễn dịch bằng nhiều cơ chế khác nhau, bao gồm giảm trình bày kháng nguyên, điều hòa tăng biểu hiện của chất ức chế apoptosis, tăng biểu hiện của các phân tử ức chế trên bề mặt tế bào và tăng cường tiết một số cytokine hoặc tuyển dụng các tế bào điều hòa để tạo ra vi môi trường ức chế miễn dịch. Là một thành phần quan trọng của TME, vi môi trường miễn dịch khối u (TIME) đề cập đến vi môi trường liên quan đến các tương tác giữa các tác nhân miễn dịch của vật chủ và các tế bào khối u; khối u có thể đối đầu với hệ thống miễn dịch của vật chủ bằng cách dần dần hình thành các điều kiện ức chế miễn dịch và sự hiện diện của các yếu tố tiền khối u và chống khối u trong TIME có thể quyết định sự tiến triển của ung thư và phản ứng với các phương pháp điều trị.
Các yếu tố ức chế miễn dịch liên quan đến tế bào khối u
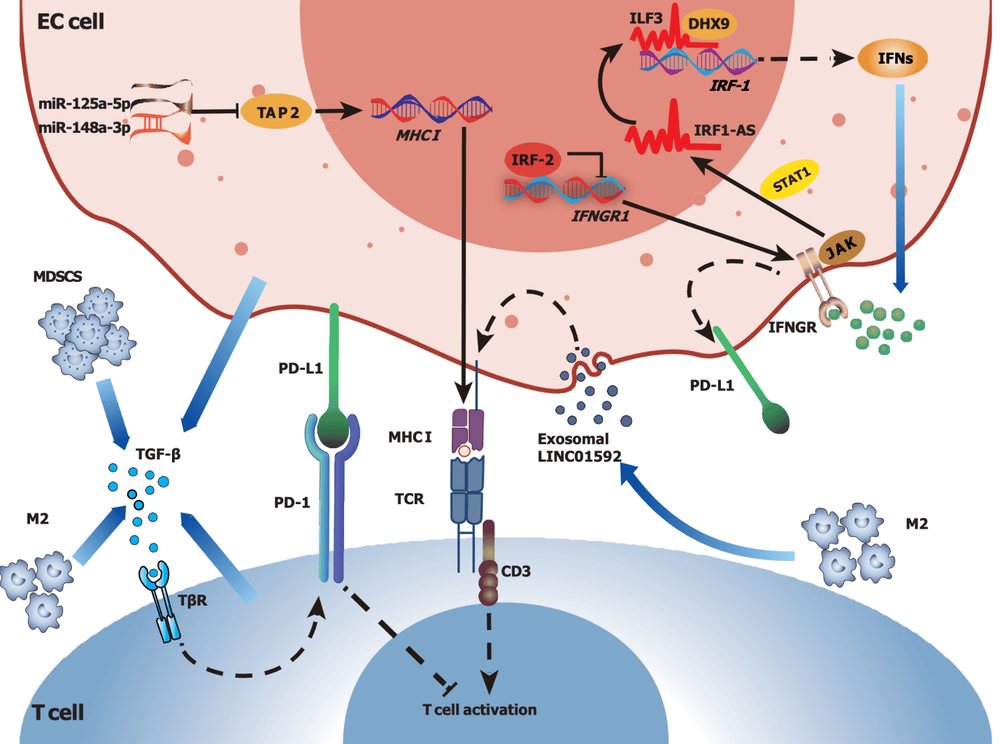
Mặc dù ung thư thực quản thể hiện khả năng đáp ứng miễn dịch mạnh như đã đề cập trước đó, nhưng nó vẫn có thể thoát khỏi tình trạng miễn dịch trong TME ức chế miễn dịch thông qua nhiều cơ chế khác nhau (Hình 1), bao gồm điều hòa giảm biểu hiện MHC, tiết ra các yếu tố ức chế miễn dịch và thay đổi quá trình chuyển hóa khối u.
Giảm điều hòa biểu hiện MHC
Thoát khỏi miễn dịch khối u thường đi kèm với sự giảm hoặc mất các phân tử MHC, đóng vai trò quan trọng trong việc nhận diện và tiêu diệt tế bào khối u bởi các tế bào miễn dịch. Đáng chú ý, biểu hiện của các phân tử HLA-ABC thường giảm hoặc thậm chí không có trong các mô ESSC. Cụ thể, một nghiên cứu trước đây đã báo cáo rằng khoảng 41% bệnh nhân ung thư thực quản không có biểu hiện HLA-ABC, hơn một nửa số bệnh nhân ung thư thực quản có biểu hiện yếu và chỉ khoảng 3% bệnh nhân ung thư thực quản có biểu hiện HLA-ABC mạnh. Ngoài ra, biểu hiện giảm hoặc không có của HLA-ABC trong ESCC có thể có mối tương quan mạnh với biểu hiện của một số phân tử tham gia vào quá trình xử lý kháng nguyên, chẳng hạn như b2m, phân họ B cassette liên kết ATP (TAP1), TAP2, LMP2 và LMP7. Hơn nữa, mất alen ở vùng 6p21.3, được quan sát thấy ở khoảng 46,9% bệnh nhân ESCC trong một nghiên cứu của Trung Quốc, đã được chứng minh là có liên quan đến việc điều hòa giảm kháng nguyên HLA lớp I và tình trạng tăng methyl hóa DNA có thể dẫn đến biểu hiện thiếu hụt các gen HLA lớp I trong ESCC.
Tiết ra các yếu tố ức chế miễn dịch
TME ức chế miễn dịch được tạo ra một phần bởi các yếu tố ức chế miễn dịch tiết ra bởi các tế bào khối u, tế bào miễn dịch và tế bào mô đệm, và các yếu tố này đóng vai trò quan trọng trong sự phát triển, hình thành mạch máu và xâm lấn của khối u, cũng như trong quá trình tiến triển ung thư thực quản. Một số cytokine ức chế miễn dịch cổ điển, chẳng hạn như TGF-β và IFN-γ, có thể ức chế chức năng của các tế bào miễn dịch, do đó làm suy yếu khả năng của hệ thống miễn dịch trong việc tấn công các tế bào khối u
Con đường truyền tín hiệu TGF-β có thể đóng vai trò kép trong quá trình phát triển ung thư tùy thuộc vào giai đoạn bệnh. Trong điều kiện bệnh lý, sự biểu hiện quá mức của TGF-β có thể dẫn đến quá trình chuyển đổi trung mô biểu mô, lắng đọng ma trận ngoại bào và hình thành nguyên bào sợi liên quan đến ung thư, dẫn đến các bệnh xơ hóa và ung thư.
Ngoài ra, TGF-β có thể hạn chế sự thâm nhiễm của tế bào T vào TME và làm giảm hoạt động miễn dịch chống khối u. Hơn nữa, TGF-β có nguồn gốc từ MDSC trong TME của ESCC có thể làm tăng biểu hiện PD-1 trong tế bào T CD8 + , dẫn đến kháng liệu pháp miễn dịch thông qua PD-1/PD-L1. Hơn nữa, sự kết hợp của việc phong tỏa TGF-β và PD-L1 đã được chứng minh là làm tăng đáng kể số lượng tế bào T xâm nhập vào khối u và làm giảm gánh nặng khối u ở bệnh nhân EAC . Con đường truyền tín hiệu IFN cũng đóng vai trò kép trong TME Sự tương tác giữa các cytokine và các con đường truyền tín hiệu trong TIME của ung thư thực quản dẫn đến việc xây dựng một mạng lưới phức tạp và một số cytokine chính, chẳng hạn như TGF-β và IFN-γ, đóng vai trò kép trong quá trình tiến triển của khối u bằng cách thúc đẩy sự phát triển của khối u và thoát khỏi miễn dịch hoặc phát huy tác dụng chống khối u.
Chuyển hóa khối u
Chuyển hóa khối u thường được đặc trưng bởi tính không đồng nhất cao và tái cấu trúc liên tục do sự tiến hóa của các tế bào ung thư, và lập trình lại chuyển hóa là một đặc điểm riêng biệt của khối u ác tính. Các tương tác động giữa các tế bào khối u và các tế bào miễn dịch khác nhau có thể dẫn đến cạnh tranh chuyển hóa trong hệ sinh thái khối u, hạn chế khả năng cung cấp chất dinh dưỡng cho các tế bào miễn dịch và dẫn đến axit hóa TME, do đó làm suy yếu chức năng của các tế bào miễn dịch. Trong một nghiên cứu trước đây, bệnh nhân ESCC được chia thành các phân nhóm nguy cơ cao và thấp dựa trên ba gen liên quan đến chuyển hóa khối u, cụ thể là CD38 , INPP5E và POLR3G , và nhóm nguy cơ cao biểu hiện giảm biểu hiện CD38 và POLR3G và tăng biểu hiện INPP5E.
Trong điều kiện normoxic, hầu hết các khối u ưu tiên dựa vào đường phân để lấy năng lượng, được coi là một lợi thế cho sự sống còn và được gọi là hiệu ứng Warburg. Một nghiên cứu gần đây đã làm nổi bật vai trò ức chế của thụ thể gamma liên quan đến estrogen trong sự xuất hiện, tăng sinh và hoạt động đường phân của các tế bào ESCC, và một trong những chất chủ vận đặc hiệu của nó, DY131, có thể ức chế sự tăng sinh và hoạt động đường phân của các tế bào ESCC bằng cách điều chỉnh một số gen cụ thể liên quan đến con đường đường phân. Ngoài ra, sự kết hợp của DY131 với sự phong tỏa PD-1 có thể có tác dụng hiệp đồng trong việc ức chế sự phát triển của ESCC. Là một sản phẩm phụ của quá trình đường phân, lactat có thể đóng vai trò điều hòa quan trọng trong sự phát triển và tiến triển của ESCC, và có mối tương quan chặt chẽ với tình trạng ức chế miễn dịch ở TME.
Hơn nữa, tình trạng thiếu oxy trong tế bào cũng liên quan đến sự tiến triển, khả năng kháng điều trị và tiên lượng kém của nhiều loại bệnh ác tính. Nhiều gen liên quan đến tình trạng thiếu oxy, chẳng hạn như PGK1 , PGM1 vàSLC2A3 ,đã được chứng minh là có liên quan đến tiên lượng xấu ở bệnh nhân EAC; EGFR và ATF3 có thể có liên quan đến tiên lượng xấu ở bệnh nhân ESCC. Ngoài ra, bệnh nhân EAC có biểu hiện PGK1 và SLC2A3 cao hơn và biểu hiện PGM1 thấp hơn , và bệnh nhân ESCC có biểu hiện ATF3 cao hơn và biểu hiện EGFR thấp hơn , có thể có sự thâm nhiễm tăng lên của các tế bào liên quan đến ức chế miễn dịch, bao gồm tế bào T CD4 + được kích hoạt bởi trí nhớ , tế bào mast được kích hoạt và đại thực bào M2.
Tài liệu tham khảo
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71:209-249
2. Siewert JR, Ott K. Are squamous and adenocarcinomas of the esophagus the same disease? Semin Radiat Oncol. 2007;17:38-44.
3. Zhang XJ, Yu Y, Zhao HP, Guo L, Dai K, Lv J. Mechanisms of tumor immunosuppressive microenvironment formation in esophageal cancer. World J Gastroenterol 2024; 30(16): 2195-2208