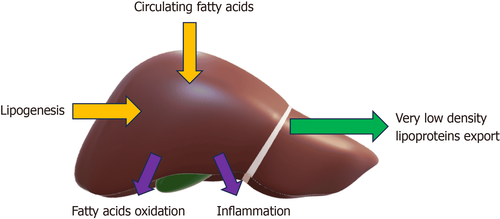
Trên thực tế, sự tích tụ quá mức lipid trong tế bào gan (dưới dạng triglyceride, hàm lượng chất béo > 5% trong gan; được gọi là mỡtosis) của những người uống rượu ở mức độ nguy cơ thấp là đặc điểm chính của bệnh nhân bệnh gan nhiễm mỡ không do rượu.
Bài viết được viết bởi ThS. BS Mai Viễn Phương - Trưởng đơn nguyên Nội soi tiêu hóa - Khoa Khám bệnh & Nội khoa - Bệnh viện Đa khoa Quốc tế Vinmec Central Park.
Về mặt lâm sàng, tình trạng này có thể giới hạn ở tình trạng gan nhiễm mỡ quá mức, được gọi là NAFL, hoặc tiến triển thành viêm hoại tử và xơ hóa, được gọi là viêm gan nhiễm mỡ không do rượu (NASH), thành xơ gan NASH và cuối cùng là HCC. Ở các nước phương Tây, ước tính một phần ba dân số nói chung bị ảnh hưởng bởi bệnh gan nhiễm mỡ không do rượu, tình trạng này có liên quan đến tình trạng thừa cân và đái tháo đường. Hơn nữa, căn bệnh này rất phổ biến ở Trung Đông và tỷ lệ mắc bệnh đang gia tăng ở tiểu lục địa Châu Á và các quốc gia Viễn Đông. Nhìn chung, bệnh gan nhiễm mỡ không do rượu đã trở thành rối loạn gan mãn tính phổ biến nhất với tỷ lệ mắc bệnh trên toàn thế giới là khoảng 25% dân số trưởng thành được công nhận là có liên quan chặt chẽ và song phương với các thành phần của hội chứng chuyển hóa.
Thách thức quan trọng nhất là xác định những người mắc bệnh gan nhiễm mỡ không do rượu có nguy cơ cao nhất gặp phải các biến chứng liên quan đến gan. Gánh nặng của bệnh gan giai đoạn cuối ước tính sẽ tăng gấp hai đến ba lần trên toàn cầu vào năm 2030. Mặc dù NALFD được chấp nhận trên lâm sàng là nguyên nhân gây tử vong liên quan đến gan tăng nhanh nhất, nổi lên như một nguyên nhân quan trọng gây ra bệnh gan giai đoạn cuối, HCC và ghép gan với gánh nặng kinh tế y tế đáng kể, bệnh gan nhiễm mỡ không do rượu vẫn chưa được đánh giá đúng mức như một rối loạn mãn tính đáng chú ý và có một số ít chiến lược hoặc chính sách quản lý. Ngoài ra, mặc dù nhiều nghiên cứu đang được tiến hành đã cho rằng một số bất thường về di truyền/chuyển hóa là nguyên nhân gây bệnh bệnh gan nhiễm mỡ không do rượu , nhưng cơ chế cơ bản mà bệnh xảy ra và tiến triển vẫn chưa rõ ràng, khiến việc chẩn đoán sớm trong phòng thí nghiệm và điều trị hiệu quả trở nên khó khăn.
Tổng quan về bệnh ferroptosis
Quá trình chết tế bào do ferroptosis ban đầu được báo cáo vào đầu thế kỷ 20 bởi một hợp chất thấm tế bào gọi là erastin, một hợp chất gây tử vong cho các tế bào ung thư của con người có đột biến RAS gây ung thư. Một thập kỷ sau, thuật ngữ ferroptosis được thiết lập để mô tả Chết tế bào theo chương trình do erastin gây ra, được trung gian bởi sự tích tụ của các peroxit lipid phụ thuộc vào sắt.
Quá trình chết tế bào do ferroptosis gây ra các hoạt động ức chế khối u, tăng mật độ màng ty thể và làm co tế bào mà không có bất kỳ biểu hiện hoại tử hoặc apoptosis điển hình nào. Tương tự như quá trình chết tế bào do pyroptosis, hai tín hiệu khác nhau bao gồm các con đường điển hình và không điển hình được mô tả là chất gây ra quá trình chết tế bào do ferroptosis. Trong con đường điển hình, enzyme glutathione (GSH) peroxidase 4 (GPX4) bị bất hoạt trực tiếp hoặc gián tiếp, gây ra quá trình chết tế bào do ferroptosis, trong khi theo cách không điển hình, nhóm sắt không ổn định được tăng lên.

Con đường điển hình của quá trình ferroptosis
Sự tương tác trực tiếp của erastin với chất vận chuyển chất mang họ 7 thành viên 5 (SLC7A5) và sự phân hủy tiếp theo sự phá vỡ quá trình vận chuyển axit amin vào tế bào bởi hệ thống Xc- xảy ra theo con đường điển hình của quá trình ferroptosis. SLC3A2 điều hòa và tiểu đơn vị xúc tác SLC7A11 là các thành phần của hệ thống Xc- chịu trách nhiệm trao đổi cystine với glutamate bằng cách thúc đẩy tăng cường hấp thu cystine vào tế bào. Cystine là tiền chất huyết tương của cysteine, rất cần thiết cho quá trình tổng hợp GSH, một hệ thống điều hòa oxy hóa khử chính. Do đó, việc chặn cystine bằng chất ức chế ( ví dụ, erastin, L-glutamate, v.v. ) sẽ dẫn đến ức chế tổng hợp GSH, ức chế GPX4 và tích tụ phospholipid hydroperoxide (PL-OOH), được coi là chất trung gian chính của phản ứng chuỗi lipoxygenase (LOX).
Ở trạng thái quá tải sắt tự do nội bào, nó tương tác với các loài oxy phản ứng cuối cùng dẫn đến sản xuất gốc hydroxyl có phản ứng cao với các đại phân tử như axit béo không bão hòa đa (PUFA). Quá trình oxy hóa PUFA thông qua con đường liên quan đến lysophosphatidylcholine acyltransferase 3, thành viên họ chuỗi dài acyl-CoA synthetase 4 và LOX là cần thiết để gây ra độc tính mỡ do ferroptosis. GPX4 được coi là thành viên duy nhất có khả năng khử hydroperoxide phospholipid màng, xác định sự đóng góp đáng kể của nó trong việc chống lại quá trình thẩm thấu của màng huyết tương, quá trình peroxy hóa lipid và cuối cùng là giải phóng DAMP. Trong con đường không điển hình, tổn thương oxy hóa và ferroptosis được thúc đẩy bởi sự hấp thụ sắt tăng cao của thụ thể transferrin và giảm xuất khẩu sắt của ferroportin.
Thông tin khan hiếm về sự tham gia của ferroptosis trong quá trình tiến triển của bệnh gan nhiễm mỡ không do rượu
Thật không may, có rất ít bằng chứng chứng minh sự đóng góp của ferroptosis trong quá trình sinh bệnh bệnh gan nhiễm mỡ không do rượu . Tuy nhiên, malondialdehyde và 4-hydroxynonenal, là các sản phẩm peroxy hóa lipid thứ cấp, được đề xuất là các dấu hiệu căng thẳng ở những bệnh nhân mắc NASH. Về vấn đề này, các chất chống oxy hóa nổi tiếng có khả năng ức chế peroxy hóa lipid như vitamin E và quercetin có khả năng làm giảm mức alanine transferase ở những bệnh nhân mắc NASH. Ngoài ra, sự tích tụ sắt do rối loạn chuyển hóa dẫn đến tình trạng NASH trầm trọng hơn khi xơ gan được báo cáo. Tương tự như vậy, tình trạng bệnh hemochromatosis nguyên phát trở nên trầm trọng hơn được quan sát thấy ở những bệnh nhân mắc NASH và quá tải sắt, trong khi việc loại bỏ sắt đi kèm với việc cải thiện tổn thương gan và mức alanine transferase. Hơn nữa, bằng chứng cho thấy vai trò của ferroptosis trong gan nhiễm mỡ đã được thảo luận. Tuy nhiên, thông tin được ghi chép về vai trò của ferroptosis trong bệnh gan nhiễm mỡ không do rượu cần được nghiên cứu thêm trên các mô hình bệnh nhân phù hợp với rối loạn này, đặc biệt là vì hiện tại không có chiến lược điều trị chính xác nào khả dụng.
Việc sửa đổi ferroptosis được coi là một lựa chọn điều trị mới để chống lại các khối u ác tính
Chất ức chế tyrosine kinase (TKI) được mô tả là phương pháp điều trị toàn thân đầu tiên được chấp thuận cho HCC tiến triển, tuy nhiên, phương pháp điều trị toàn thân HCC đã được phát triển hơn nữa với chất ức chế điểm kiểm soát miễn dịch. Bằng chứng gần đây cho thấy phương pháp điều trị bằng atezolizumab cộng với bevacizumab tốt hơn sorafenib. May mắn thay, những phát hiện mới nhất đã gợi ý các chiến lược điều trị mới dựa trên các sửa đổi Chết tế bào theo chương trình để chống lại HCC. Lenvatinib, một TKI nổi tiếng, có thể ngăn chặn sự tiến triển của HCC thông qua việc gây ra ferroptosis thông qua việc ức chế thụ thể yếu tố tăng trưởng nguyên bào sợi-4. Một ví dụ khác là capecitabine Metronomic đã được đề xuất là liệu pháp điều trị tuyến hai ở những bệnh nhân HCC sau khi thất bại với sorafenib hoặc ngừng thuốc. Tương tự như vậy, nghiên cứu do Wang và cộng sự thực hiện chỉ ra khả năng của capecitabine metronomic trong việc gây ra chứng chết tế bào do ferroptosis ở tế bào T CD4+, có thể là do sự thoái hóa GPX4 liên quan đến tự thực trong các tế bào miễn dịch này, đã làm giảm tình trạng đào thải ghép gan.
Tương tự như vậy, artesunate được coi là liệu pháp kết hợp thích hợp và được dung nạp tốt, có tác dụng hiệp đồng với sorafenib để thúc đẩy chứng chết tế bào do ferroptosis ở tế bào HCC. Hơn nữa, GSH S-transferase zeta 1, một loại enzyme tham gia vào quá trình dị hóa phenylalanine, có thể ức chế trục NRF2/GPX4 dẫn đến làm tế bào HCC nhạy cảm hơn với chứng chết tế bào do ferroptosis do sorafenib gây ra. Tương tự như vậy, tiliroside gây ra chứng chết tế bào do ferroptosis thông qua việc nhắm mục tiêu vào kinase liên kết TANK 1 dẫn đến cái chết của các tế bào HCC kháng sorafenib. Do đó, có vẻ như cần phải có thêm nhiều nghiên cứu nữa để giải quyết tác động của chất điều biến ferroptosis đối với quá trình chết của các tế bào HCC được điều trị bằng thuốc hóa trị.
Tài liệu tham khảo
1. Younossi ZM, Golabi P, Paik JM, Henry A, Van Dongen C, Henry L. The global epidemiology of nonalcoholic fatty liver disease (bệnh gan nhiễm mỡ không do rượu ) and nonalcoholic steatohepatitis (NASH): a systematic review. Hepatology. 2023;77:1335-1347
2. Estes C, Razavi H, Loomba R, Younossi Z, Sanyal AJ. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease. Hepatology. 2018;67:123-133.
3. Sun HJ, Jiao B, Wang Y, Zhang YH, Chen G, Wang ZX, Zhao H, Xie Q, Song XH. Necroptosis contributes to non-alcoholic fatty liver disease pathoetiology with promising diagnostic and therapeutic functions. World J Gastroenterol 2024; 30(14): 1968-1981