Dạng di động của Entamoeba histolytica , thể tư dưỡng, sống trong lòng ruột già, nơi nó nhân lên và biệt hóa thành nang, dạng kháng thuốc chịu trách nhiệm truyền bệnh nhiễm trùng. Nang được bài tiết qua phân và có thể được vật chủ mới nuốt vào qua thức ăn hoặc nước bị ô nhiễm.
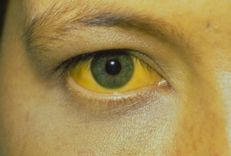
Tùy thuộc vào cơ quan bị ảnh hưởng, các biểu hiện lâm sàng của bệnh amip là ở ruột hoặc ngoài ruột. Có bốn dạng lâm sàng của bệnh amip xâm lấn đường ruột, tất cả đều thường cấp tính: kiết lỵ hoặc tiêu chảy ra máu, viêm đại tràng cấp tính, viêm ruột thừa do amip và u amip ở đại tràng.
Bài viết được viết bởi ThS.BS Mai Viễn Phương - Bác sĩ nội soi tiêu hóa, Khoa Khám bệnh & Nội khoa - Bệnh viện Đa khoa Quốc tế Vinmec Central Park.
Xói mòn biểu mô bề mặt
Sau khi hàng rào chất nhầy bị phá vỡ, E. histolytica sẽ tiếp cận bề mặt lòng ruột và ban đầu tạo ra sự xói mòn biểu mô nông và cục bộ phụ thuộc vào tiếp xúc. Trong ống nghiệm, kỹ thuật quay phim vi mô theo thời gian đã chỉ ra rằng cơ chế gây hấn của E. histolytica là một hiện tượng đa yếu tố phức tạp bao gồm sự bám dính, tổn thương “đánh và chạy” phụ thuộc vào tiếp xúc với màng huyết tương của tế bào hiệu ứng, thực bào và sự phân hủy nội bào của các tế bào bị nuốt vào. Các sự kiện bám dính và tiêu tế bào có liên quan đến ba loại phân tử: lectin, amebapores, and proteases.
(i) Phân tử Lectin Gal-GalNAc
Sự bám dính của ký sinh trùng chủ yếu xảy ra thông qua lectin Gal-GalNAc bề mặt liên kết với các gốc Gal-GalNAc đầu cuối lộ ra của glycoprotein tế bào đích . Các phân tử khác bao gồm lectin 220-kDa, adhesin 112-kDa và lipophosphoglycan bề mặt. Người ta cho rằng lectin Gal-GalNAc có thể được chuyển đến bề mặt bên của tế bào ruột trước khi ký sinh trùng phát huy tác dụng phân giải tế bào, nhưng lợi ích của tác động này đối với ký sinh trùng vẫn chưa rõ ràng.
Chất kết dính Gal-GalNAc là một protein đa chức năng bao gồm một dị hợp tử của các tiểu đơn vị nặng (170-kDa) và nhẹ (35/31-kDa). Bằng chứng về sự tham gia của phân tử này trong sự kiện kết dính của ký sinh trùng đã được chứng minh bằng sự kết dính của amip với hồng cầu, bạch cầu trung tính, chất nhầy đại tràng và biểu mô của người và với một số vi khuẩn khi lectin bị galactose ức chế.
Tiểu đơn vị nặng của chất kết dính Gal-GalNAc được mã hóa bởi năm gen trong chủng E. histolytica HM1:IMSS. Các trình tự axit amin có nguồn gốc cho thấy rằng tiểu đơn vị nặng là một protein màng tích phân với một đuôi tế bào chất nhỏ và một miền đầu N ngoại bào lớn chứa một vùng giàu cysteine. Với sự trợ giúp của các kháng thể đơn dòng, một số yếu tố quyết định kháng nguyên ảnh hưởng đến khả năng bám dính và khả năng kháng bổ thể đã được ánh xạ vào vùng này (được xem xét trong tài liệu tham khảo. Hơn nữa, miền nhận dạng carbohydrate nằm trong vùng giàu cysteine của lectin. Tiểu đơn vị ánh sáng cho thấy hai dạng đồng phân 35 và 31-kDa, với dạng sau có neo glycosylphosphatidylinositol. Tiểu đơn vị này cũng được mã hóa bởi một họ gen có trình tự nucleotide giống nhau từ 79 đến 85%. Chức năng của nó vẫn chưa rõ ràng nhưng có vẻ liên quan đến việc điều chỉnh hoạt động gây bệnh tế bào của ký sinh trùng.
So sánh giữa Entamoeba histolytica và E. dispar cho thấy các chất kết dính Gal-GalNAc rất giống nhau, liên kết hiệu quả với các tế bào đích và chất nhầy đại tràng. Trình tự axit amin có nguồn gốc được mã hóa bởi các gen tương đồng cho thấy các dòng tiểu đơn vị nặng và nhẹ của E. dispar giống hệt nhau 86 và 79% về cấu trúc chính so với các dòng tương ứng của chúng ở E. histolytica. Trong ống nghiệm, E. dispar thể hiện khả năng bám dính và gây độc tế bào đối với các tế bào đích thông qua lectin Gal-GalNAc, mặc dù ở mức độ thấp hơn so với E. histolytica. Những quan sát này phù hợp với khả năng của E. dispar trong việc tạo ra các vết xói mòn nông ở niêm mạc đại tràng của động vật thí nghiệm nhưng vẫn chưa có lời giải đáp cho câu hỏi tại sao loài amip này không xâm lấn thêm nữa.
(ii) Phân tử amebapores
Khi Entamoeba histolytica thiết lập tiếp xúc với các tế bào động vật có vú trong ống nghiệm, một sự kiện ly giải tế bào nhanh chóng diễn ra dẫn đến sưng tấy, phồng rộp bề mặt và ly giải tế bào đích vô tình, bao gồm tế bào lympho, bạch cầu đa nhân và đại thực bào, khiến ký sinh trùng không bị tổn hại. Sự tương đồng của sự kiện này với sự ly giải tế bào đích do perforin làm trung gian bởi tế bào lympho T gây độc tế bào ban đầu cho thấy sự tham gia của một protein tạo kênh gọi là amebapore, hoạt động của nó đã được xác định trong dịch ly giải E. histolytica.
Amebapore của E. histolytica là một peptide tạo kênh gồm 77 gốc axit amin, hiện đã được tinh chế; protein đã được giải trình tự và các gen tương ứng đã được nhân bản. Ba dạng đồng phân, amebapore A, B và C, có mặt theo tỷ lệ lần lượt là 35:10:1, với các gen cho thấy 35 đến 57% tính đồng nhất trình tự axit amin được suy ra. Các phân tử chia sẻ sáu gốc cysteine ở các vị trí giống hệt nhau và một gốc histidine gần đầu C. Mô hình cấu trúc cho thấy một cấu trúc bậc ba nhỏ gọn bao gồm bốn cấu trúc xoắn α được ổn định bởi ba liên kết disulfide. Do đó, amebapore khác với các perforin lớn hơn nhiều (65 đến 70 kDa) chứa ba phân đoạn lưỡng tính, hai xoắn α và một phiến β. Tuy nhiên, người ta đã tìm thấy điểm tương đồng ở cấp độ cấu trúc và chức năng giữa amip và NK-lysin, một loại polypeptide có trong tế bào tiêu diệt tự nhiên (NK) và tế bào lympho T gây độc của lợn.
Giống như các peptit tạo lỗ khác, các amebpore dễ hòa tan nhưng có khả năng nhanh chóng chuyển sang giai đoạn chèn màng. Các quan sát ban đầu cho thấy rằng phân tử này tạo thành các kênh đa trạng thái có các đặc tính tương tự như các đặc tính được tìm thấy trong các tập hợp barrel-stave của các độc tố như alamethacin. Với việc làm sáng tỏ các cấu trúc chính và thứ cấp, hiện nay người ta tin rằng các amebpore tập hợp thông qua sự sắp xếp các α-helice lưỡng tính của chúng. Trong một mô hình do Andrä và Leippe đề xuất, các amebpore liên kết với các phospholipid tích điện âm thông qua các gốc lysine được proton hóa; sau đó là sự chèn peptide vào lớp kép lipid được thúc đẩy bởi điện thế màng âm của màng mục tiêu.
Quá trình oligomer hóa peptide xảy ra với sự tham gia của một gốc histidine quan trọng (His 75 ), có thể tương tác với một monome khác thông qua sự hình thành các liên kết hydro hoặc ổn định α-helix thứ tư được dự đoán. Oligomer tạo thành một kênh xuyên qua màng tế bào, cho phép nước, ion và các phân tử nhỏ khác đi qua và do đó phá vỡ tế bào mục tiêu.
Các lỗ amip được định vị trong các túi tế bào chất, bằng chứng là nhuộm miễn dịch huỳnh quang dương tính và sự hiện diện của các peptit tín hiệu điển hình của quá trình vận chuyển nội bào trong các sản phẩm dịch mã chính của nó. Các peptit cho thấy hoạt động tối đa ở độ pH axit, phù hợp với các quan sát trước đây rằng sự phân hủy các tế bào đích của E. histolytica cần độ pH là 5,0 trong các túi amip.
Đáng ngạc nhiên là, mặc dù có tất cả những tiến bộ trong sinh hóa học và sinh học phân tử của amippore, sự tham gia của chúng vào sự kiện phân hủy tế bào do E. histolytica tạo ra vẫn chưa được chứng minh. Amippore không được tiết ra một cách tự nhiên từ các trophozoite sống. Liệu phân tử có thể chèn vào màng tế bào mục tiêu khi bám dính trong cơ thể sống hay không vẫn chưa được xác định.
Các ổ vi xâm lấn giữa các tuyến
Các vết xói mòn biểu mô bề mặt khu trú do E. histolytica gây ra ở người tiếp theo là các ổ vi xâm lấn nhỏ giữa các tuyến. Các nghiên cứu kính hiển vi điện tử trên các loài gặm nhấm bị nhiễm bệnh thực nghiệm đã xác nhận sự xâm lấn của các thể tư dưỡng qua biểu mô giữa các tuyến, nơi diễn ra quá trình bong tróc rõ rệt của các tế bào biểu mô bong tróc. Quá trình bong tróc bề mặt dường như khiến khu vực này đặc biệt dễ bị xâm lấn, xảy ra thông qua sự dịch chuyển tích cực của các amip với các chân giả lớn kéo dài về phía các lớp biểu mô đáy. Trong quá trình di chuyển đến các lớp sâu hơn của ruột, các động vật tư dưỡng phải phân hủy các tế bào xung quanh và phân hủy các thành phần của ma trận ngoại bào (ECM) của niêm mạc đại tràng. Do đó, giai đoạn tổn thương này được đặc trưng bởi sự phân hủy liên tục của các tế bào, sự xâm nhập thông qua chuyển động và sự phân hủy protein của ECM.
Tài liệu tham khảo
1. Adler P, Wood S J, Lee Y C, Lee R T, Petri W A, Jr, Schnaar R L. High affinity binding of the Entamoeba histolytica lectin to polyvalent N-acetylgalactosaminides. J Biol Chem. 1995;270:5164–5171.
2. Aguirre A, Warhurst D C, Guhl F, Frame I A. Polymerase chain reaction-solution hybridization enzyme-linked immunoassay (PCR-SHELA) for the differential diagnosis of pathogenic and non-pathogenic Entamoeba histolytica. Trans R Soc Trop Med Hyg. 1995;89:187–188.