Bài viết được viết bởi TS. Nguyễn Hồng Thanh - Chuyên viên Nghiên cứu, Trung tâm Công nghệ cao Vinmec
Mới đây, cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt xét nghiệm chẩn đoán đồng hành để xác định bệnh nhân có các dạng đột biến cụ thể của gen EGFR ở dạng di căn trong ung thư phổi không tế bào nhỏ (NSCLC), đánh dấu lần đầu tiên sự kết hợp hai công nghệ: Giải trình tự gen thế hệ mới - NGS và Sinh thiết lỏng - trong một xét nghiệm chẩn đoán để đưa ra các quyết định điều trị được phê duyệt.
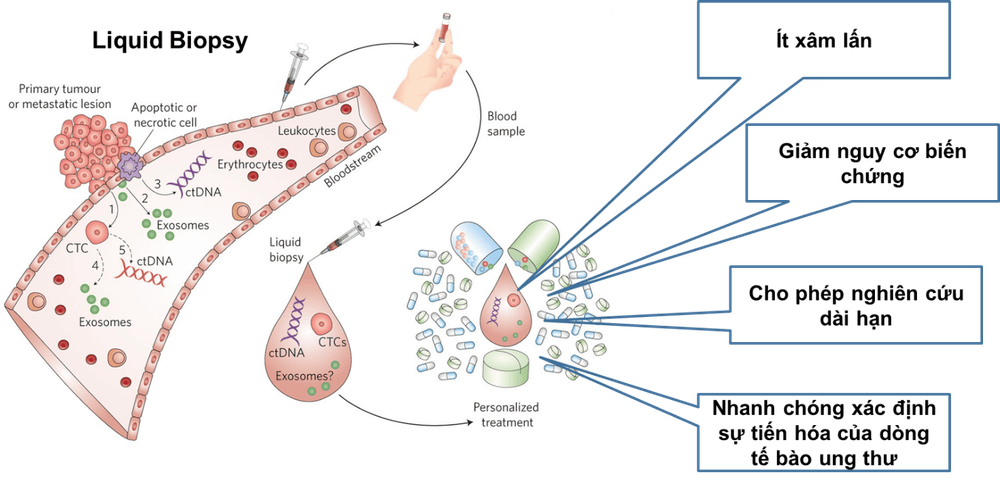
Xét nghiệm có tên CDx của Guardant 360 ứng dụng 2 công nghệ:
- Công nghệ thứ nhất là Sinh thiết lỏng: sử dụng mẫu máu để cung cấp cho các chuyên gia thông tin di truyền về khối u của bệnh nhân. Phương pháp này ít xâm lấn và có thể lặp lại nhiều lần so với sinh thiết mô theo cách truyền thống. Hơn nữa, các xét nghiệm sinh thiết lỏng có thể được sử dụng trong trường hợp sinh thiết mô tiêu chuẩn không khả thi, như trong trường hợp vị trí của khối u khó tiếp cận.
- Công nghệ thứ hai là NGS: sử dụng giải trình tự gen bảng lớn, được gọi là định dạng khối u thông lượng cao. So với các công nghệ cũ, NGS chỉ yêu cầu xét nghiệm một lần, cho phép các bác sĩ lâm sàng đánh giá tốt hơn về thành phần khối u, đem lại lợi ích trong việc phân tích các đột biến gen có ảnh hưởng tới khối u. công nghệ NGS giúp xét nghiệm CDx Guardant 360 phát hiện đồng thời các đột biến trên 55 gen trong khối u, thay vì chỉ trên một gen tại một thời điểm.

Guardant 360 CDx được FDA phê duyệt lần này với mục đích đồng thời cung cấp thông tin về nhiều biomarker trong khối u rắn và giúp xác định các đột biến gen EGFR ở những bệnh nhân ung thư phổi tế bào không nhỏ (NSCLC) di căn đáp ứng với điều trị bằng TAGRISSO (osimertinib). Ung thư phổi là nguyên nhân gây tử vong do ung thư hàng đầu ở nam giới và phụ nữ Hoa Kỳ, trong đó NSCLC là loại ung thư phổi phổ biến nhất.
Thử nghiệm CDx của Guardant360 đã được cấp chứng chỉ Thiết bị Đột phá, trong đó FDA thực hiện hợp tác và hướng dẫn chuyên sâu cho công ty trong việc phát triển thiết bị hiệu quả. FDA đã cấp phép thử nghiệm sản phẩm CDx Guardant 360 cho Guardant Health.
FDA, một cơ quan thuộc Bộ Y tế và Dịch vụ Nhân sinh Hoa Kỳ, có trách nhiệm bảo vệ sức khỏe cộng đồng bằng cách đảm bảo tính an toàn, hiệu quả và độ tin cậy của thuốc dùng cho con người và động vật, vắc xin và các sản phẩm sinh học khác dùng cho con người và các thiết bị y tế. Cơ quan này cũng chịu trách nhiệm về sự an toàn và tin cậy của nguồn cung cấp thực phẩm, mỹ phẩm, thực phẩm chức năng, các thiết bị phát bức xạ điện tử và kiểm soát các sản phẩm thuốc lá.
Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.