Bài viết được viết bởi BS.TS Hoàng Minh Đức - Trưởng nhóm Dự án sản xuất thử nghiệm, Viện nghiên cứu Tế bào gốc và Công nghệ gen Vinmec
Việc lưu trữ các dòng tế bào gốc BM-MSC, AD-MSC, và UC-MSCs như một nguồn tế bào có thể sử dụng trong tương lai khi cần thiết là một nhu cầu thích đáng và khả thi của khách hàng.
3. Tổng quan về tế bào gốc trung mô từ dây rốn
3.1 Cấu trúc và hình thái học của dây rốn
Trong quá trình phát triển phôi ở người, dây rốn được hình thành từ màng phôi sau thụ tinh và màng niệu nang trở thành một bộ phận đặc biệt kết nối giữa thai nhi, nhau thai và người mẹ. Trong dây rốn có chứa một loại chất nhầy dạng sệt được tìm ra bởi Thomas Wharton và thường được gọi là Wharton’s jelly (WJ) [6].
Chức năng chính của lớp màng nhầy này là bảo vệ các mạch máu bên trong dây rốn (bao gồm 2 tĩnh mạch và 1 động mạch) cũng như ngăn ngừa các hiện tượng tắc nghẽn, xoắn vặn dây rốn. Lớp màng nhầy được cấu tạo đa phần từ glycosaminoglycans, đặc biệt là hợp chất hyaluronic acid và chondroitin sulfate [7].
Ngoài các hợp chất trên, dây rốn được cấu tạo đa phần bởi các sợi collagen tạo nên mạng lưới sợi chạy dọc chiều dài của dây rốn làm tăng độ dẻo dai, độ bền và tính toàn vẹn của cấu trúc. Các thành phần tế bào cấu tạo nên dây rốn đa phần là các tế bào thuộc lớp trung mô như tế bào sợi, tế bào cơ, tế bào cơ trơn và tế bào gốc trung mô. Khác với các loại mô khác trong cơ thể con người, lớp WJ không hề chứa mạng lưới mao mạch hay các mạch máu nhỏ [8].
Theo các nghiên cứu về sự phát triển của phôi, thì quá trình phát triển hệ mạch máu và tái tạo máu bên trong dây rốn được bắt đầu từ tuần thứ 6 của quá trình hình thành phôi thai, nhưng từ tuần tứ 7 đến 9 của thai kỳ, quá trình này dừng hẳn và các mao mạch bắt đầu mất dần trong toàn bộ cấu trúc dây rốn.
3.2 Tế bào gốc trung mô từ dây rốn (TBGTMDR)
Những nghiên cứu về dây rốn bắt nguồn từ việc phát hiện ra nguồn tế bào gốc tạo máu từ chính máu dây rốn vào năm 1974, nhưng tại thời điểm đó dây rốn lại được coi là một rác thải trong y khoa và không có giá trị về khoa học [9].
Tuy nhiên, quan điểm này hoàn toàn bị xoá bỏ vào năm 1991 khi McElreavey và các cộng sự phân lập thành công các tế bào dạng sợi (fibroblast-like cells) từ lớp màng nhầy Wharton’s Jelly và tiến hành phân tích đặc tính sinh học của các dòng tế bào này [10].
Năm 2004, đặc tính sinh học của các dòng tế bào dạng sợi từ dây rốn được chứng minh là tế bào gốc trung mô thông qua khả năng tăng sinh, khả năng biệt hoá và có các marker bề mặt như CD29, CD44, CD51, CD73, CD90 và CD105.
Quan trọng nhất là các tế bào này không có các marker bề mặt của tế bào gốc tạo máu như CD34 và CD45 [11].
Các đặc tính trên tương đồng hoàn toàn với khái niệm tế bào gốc trung mô được hiệp hội liệu pháp tế bào thế giới (Internaltional Society for Cell Therapy – ISCT) quy định [12].
Hiện tại, TBGTMDR có thể được phân lập từ toàn bộ các phần của dây rốn hay từ những bộ phận riêng lẻ cấu thành của dây rốn như các tế bào TBGTMDR lấy từ động mạch và tĩnh mạch, màng dây rốn và lấy từ khối nhầy WJ.
![Hình 1: Các tế bào gốc trung mô được tìm thấy tại các cấu phần khác nhau của dây rốn [13].](/static/uploads/20200915_130137_157677_screenshot_16001748_max_1800x1800_png_ad52c226a7.png)
4. Các ứng dụng của tế bào gốc trung mô
Trên thế giới, FDA đã cho phép thực hiện các thí nghiệm lâm sàng (từ phase 1-3) để đánh giá tính an toàn và hiệu quả của việc sử dụng tế bào gốc trung mô trong điều trị các bệnh lý lâm sàng.
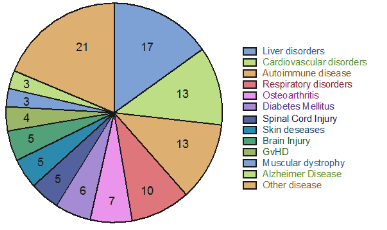
Theo trang web clinicaltrial.gov, tế bào gốc trung mô đã được ứng dụng để điều trị trên 374 loại bệnh khác nhau từ các bệnh như rối loạn chuyển hóa, rối loạn hệ miễn dịch cho đến các bệnh như Alzheimer, chấn thương thần kinh, bệnh lý liên quan đến tim mạch (theo thống kê của Clinicaltrial.gov, https://clinicaltrials.gov/) với hơn 115 nghiên cứu độc lập trên toàn thế giới (Hình 2).
Trong các nghiên cứu về lâm sàng kể trên, việc truyền tế bào gốc trung mô vào cơ thể bệnh nhân không ghi nhận các trường hợp có ảnh hưởng bất lợi đến sức khỏe người bệnh, trừ một số trường hợp bệnh nhân sốt nhẹ, hoặc ói.
Các nghiên cứu về TBGTMDR thường tập trung vào cấy dị ghép đồng loài (Allogeneic Stem Cell Transplantation) bằng việc sử dụng tế bào gốc trung mô tự thân từ tủy xương và mô mỡ vì việc lưu trữ tế bào gốc trung mô từ dây rốn mới bắt đầu trong những năm gần đây khi kỹ thuật phân lập và nuôi cấy tế bào đang được phát triển.
Do vậy, rất ít bệnh nhân có khả năng lưu trữ dây rốn của mình để sử dụng với mục đích ghép tự thân. Tuy nhiên, vẫn có những nghiên cứu so sánh hiệu quả giữa liệu pháp tế bào gốc tự thân và dị ghép đồng loài.
Hiện nay, tại Viện nghiên cứu, các tế bào gốc trung mô từ tủy xương và mô mỡ đã được sử dụng để đánh giá tính an toàn và hiệu quả trong điều trị bệnh tiểu đường và rối loạn nội tiết tố ở tuổi trung niên. Kết quả ban đầu cho thấy khối tế bào gốc nuôi cấy không gây bất kỳ phản ứng hay biến cố bất lợi nào.
Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.
Tài liệu tham khảo:
- Friedenstein, A.J., J.F. Gorskaja, and N.N. Kulagina, Fibroblast precursors in normal and irradiated mouse hematopoietic organs. Exp Hematol, 1976. 4(5): p. 267-74.
- Sadan, O., E. Melamed, and D. Offen, Bone-marrow-derived mesenchymal stem cell therapy for neurodegenerative diseases. Expert Opin Biol Ther, 2009. 9(12): p. 1487-97.
- Morrison, S.J. and D.T. Scadden, The bone marrow niche for haematopoietic stem cells. Nature, 2014. 505(7483): p. 327-34.
- Pittenger, M.F., et al., Multilineage potential of adult human mesenchymal stem cells. Science, 1999. 284(5411): p. 143-7.
- Kappy, N.S., et al., Human Adipose-Derived Stem Cell (ASC) Treatment Modulates Cellular Protection in Both in Vitro and in Vivo Traumatic Brain Injury Models. J Trauma Acute Care Surg, 2017.
- SPEERT, H., Obstetric-gynecologic eponyms; Thomas Wharton and the jelly of the umbilical cord. Obstet Gynecol, 1956. 8(3): p. 380-2.
- Majore, I., et al., Growth and differentiation properties of mesenchymal stromal cell populations derived from whole human umbilical cord. Stem Cell Rev, 2011. 7(1): p. 17-31.
- Donders, R., et al., Human Wharton's Jelly-Derived Stem Cells Display a Distinct Immunomodulatory and Proregenerative Transcriptional Signature Compared to Bone Marrow-Derived Stem Cells. Stem Cells Dev, 2018. 27(2): p. 65-84.
- Knudtzon, S., In vitro growth of granulocytic colonies from circulating cells in human cord blood. Blood, 1974. 43(3): p. 357-61.
- McElreavey, K.D., et al., Isolation, culture and characterisation of fibroblast-like cells derived from the Wharton's jelly portion of human umbilical cord. Biochem Soc Trans, 1991. 19(1): p. 29S.
- Can, A., F.T. Celikkan, and O. Cinar, Umbilical cord mesenchymal stromal cell transplantations: A systemic analysis of clinical trials. Cytotherapy, 2017. 19(12): p. 1351-1382.
- Galipeau, J., et al., International Society for Cellular Therapy perspective on immune functional assays for mesenchymal stromal cells as potency release criterion for advanced phase clinical trials. Cytotherapy, 2016. 18(2): p. 151-9.
- Cell4life. The benefits of storing umbilical cord tissue stem cells. 2016 [cited 2018 10 March]; Available from: cells4life.com