Bài viết bởi Thạc sĩ, Bác sĩ Mai Viễn Phương - Bác sĩ nội soi tiêu hóa - Khoa Khám bệnh & Nội khoa - Bệnh viện Đa khoa Quốc tế Vinmec Central Park
Việc ứng dụng trí tuệ nhân tạo trong bệnh lý loạn sản Barrett thực quản và ung thư biểu mô tuyến thực quản giai đoạn sớm luôn được đánh giá mang đến hiệu quả cao trong việc chẩn đoán. Nhờ đó việc điều trị trở lên chinhs xác và hiệu quả hơn.
Chữ viết tắt:
EC: Ung thư thực quản
AI: artificial intelligence
Barrett thực quản (BE)
1. Tổng quan về ứng dụng của trí tuệ nhân tạo với nội soi tiêu hoá
Do diễn tiến nhanh và tiên lượng xấu của ung thư thực quản (EC) nên việc phát hiện và chẩn đoán sớm ung thư thực quản có giá trị rất lớn trong việc cải thiện tiên lượng cho bệnh nhân. Tuy nhiên, nội soi phát hiện sớm ung thư thực quản, đặc biệt là loạn sản Barrett hoặc loạn sản biểu mô vảy thực quản, rất khó. Do đó, yêu cầu về phương pháp phát hiện các đặc điểm ung thư thực quản sớm hiệu quả hơn đã dẫn đến nghiên cứu chuyên sâu trong lĩnh vực trí tuệ nhân tạo (AI). Kỹ thuật học và ghi nhớ Deep learning (DL) đã mang lại những đột phá trong việc xử lý hình ảnh, video và các khía cạnh khác, trong khi hệ thống mạng nơ-ron phức tạp (CNN) đã mở đường cho việc phát hiện hình ảnh và video nội soi có độ phân giải cao. Nhiều nghiên cứu trên hệ thống mạng nơ-ron phức tạp trong phân tích hình ảnh nội soi ung thư thực quản sớm cho thấy hiệu suất tuyệt vời bao gồm độ nhạy, độ đặc hiệu và tiến triển dần dần từ phân tích hình ảnh in vitro để phân loại đến phát hiện thời gian thực của khối u thực quản sớm trên thực hành.


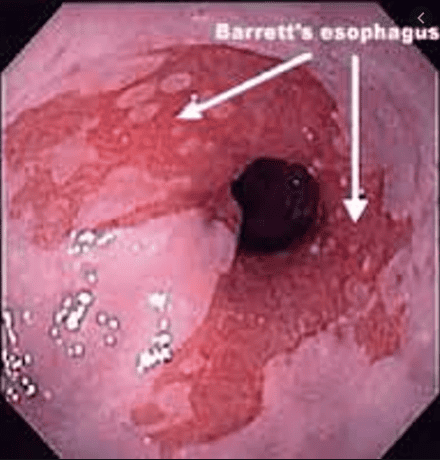
2. Chứng loạn sản Barrett và ung thư biểu mô tuyến thực quản giai đoạn sớm
Trí tuệ nhân tạo AI dựa trên hệ thống nội soi ánh sáng trắng (WLE) và hệ thống nội soi dải tần số hẹp NBI, có một số hạn chế để nhận ra các tổn thương ung thư sớm liên quan đến Barrett thực quản bằng WLE, một công nghệ thông thường. WLE độ nét cao (HD-WLE) và hệ thống nội soi NBI đã từng được coi là để nâng cao độ chính xác của việc chẩn đoán các tổn thương ung thư sớm liên quan đến Barrett thực quản. Nhưng sự cải tiến vẫn chưa làm hài lòng các bác sĩ nội soi. Tình huống này đã kích thích sự phát triển của hệ thống CAD cho các tổn thương ung thư sớm ở Barrett thực quản dựa trên thuật toán học máu ML được giám sát. Tuy nhiên, hệ thống này vẫn gặp khó khăn trong việc xác định các tổn thương ung thư sớm liên quan đến Barrett thực quản và chọn các vị trí sinh thiết.
Để giải quyết những vấn đề đó, Ebigbo và cộng sự đã thiết lập một hệ thống CAD dựa trên thuật toán học sâu. Độ chính xác của hệ thống sử dụng HD-WLE tốt hơn so với hệ thống nội soi nói chung. Hơn nữa, hệ thống hiển thị khả năng xác định vị trí tổn thương và tỷ lệ trùng khớp vùng giữa các tổn thương do hệ thống và các chuyên gia khoanh vùng lên đến 72%. Nói chung, độ đặc hiệu của NBI cao hơn so với WLE thông thường.
So với HD-WLE, hệ thống không có lợi thế rõ ràng khi sử dụng hệ thống NBI. Tuy nhiên, có một vấn đề chung trong các nghiên cứu trên nghĩa là, cùng một tập dữ liệu hình ảnh đã được sử dụng trong cả giai đoạn đào tạo và giai đoạn xác nhận. Điều này rõ ràng không thể phản ánh thực hành lâm sàng, vì vậy điều rất quan trọng là sử dụng các bộ dữ liệu hình ảnh khác nhau để đào tạo và xác nhận.
De Groof và cộng sự đã sử dụng các hình ảnh HD-WLE khác nhau để đào tạo và thử nghiệm, kết quả cho thấy độ nhạy và độ đặc hiệu của hệ thống cao hơn đáng kể so với các bác sĩ nội soi nói chung. Sự kết hợp giữa AI và HD-WLE / NBI, được sử dụng rộng rãi trong phòng khám, thực hiện tốt trong chẩn đoán các tổn thương khối u sớm liên quan đến BE và vượt trội hơn so với các bác sĩ nội soi nói chung. Tuy nhiên, trong các nghiên cứu khác nhau, độ chính xác của hệ thống CAD trong việc phân định tổn thương và tiêu chuẩn đánh giá khả năng xác định vị trí tổn thương là khá mâu thuẫn. Cần có nhiều nghiên cứu chất lượng cao hơn trong tương lai.

3. Chẩn đoán theo thời gian thực bằng AI
ưu hóa hệ thống CAD dựa trên nghiên cứu trước đó và lần đầu tiên áp dụng vào phát hiện thời gian thực lâm sàng. Trong khi 14 bệnh nhân ung thư Barrett được kiểm tra nội soi, 62 hình ảnh nội soi (36 ung thư biểu mô thực quản sớm và 26 Barrett thực quản không loạn sản) được chụp bằng hệ thống CAD để phân loại theo thời gian thực, kết quả cho thấy độ nhạy và độ đặc hiệu là 83,7% và 100 %, tương ứng. Không có sự khác biệt đáng kể giữa hệ thống và các bác sĩ nội soi có kinh nghiệm. Tuy nhiên, vẫn còn một số thiếu sót trong nghiên cứu này. Thứ nhất, số lượng bệnh nhân và hình ảnh thấp. Thứ hai, hệ thống vẫn sử dụng hình ảnh để chẩn đoán, không phải video để phát hiện thời gian thực. Cuối cùng, khả năng hỗ trợ phân định tổn thương và hướng dẫn sinh thiết của AI vẫn chưa được xác minh.
Ngoài ra, hệ thống CAD được xây dựng bởi Hashimoto và cộng sự, có thể đáp ứng nhu cầu phát hiện thời gian thực trên lâm sàng; Thật không may, các nhà nghiên cứu đã không xác minh hiệu suất của hệ thống trong chẩn đoán thời gian thực.

4. Loạn sản vảy thực quản và ung thư tế bào vảy thực quản giai đoạn sớm
Trí tuệ nhân tạo AI dựa trên WLE và NBI: Nội soi sắc tố của Lugol là phương pháp sàng lọc tiêu chuẩn cho ung thư biểu mô tế bào vảy thực quản, tuy nhiên, do độ đặc hiệu thấp và thời gian tiêu thụ lâu nên cần phải áp dụng các kỹ thuật nội soi mới. Mặc dù WLE đã được chứng minh là không phù hợp để sàng lọc ung thư biểu mô tế bào vảy thực quản sớm một mình, nhưng xét về tính phổ biến lâm sàng một số nhà nghiên cứu vẫn hy vọng giới thiệu AI để cải thiện độ chính xác của WLE.
Cai và cộng sự đã xây dựng một hệ thống CAD dựa trên DL và thử nghiệm với các hình ảnh WLE. Kết quả cho thấy độ chính xác của hệ thống trong chẩn đoán ung thư thực quản sớm cao hơn đáng kể so với các bác sĩ nội soi tuyến cơ sở, trung cấp và không có sự khác biệt đáng kể giữa hệ thống và các bác sĩ nội soi cao cấp. Kết quả của Ohmori và cộng sự cho thấy độ nhạy của NBI cao hơn WLE, nhưng độ đặc hiệu thấp hơn và không có sự khác biệt đáng kể giữa hiệu suất tổng thể của hệ thống và các chuyên gia nội soi. Kết quả của Horie và cộng sự tương tự như kết quả của Ohmori.
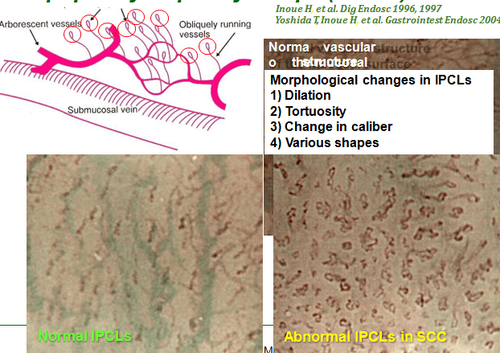
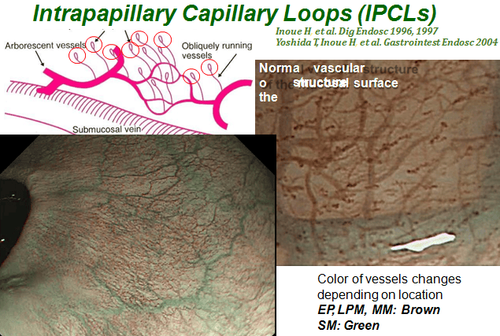
Trong những năm gần đây, người ta nhận thấy rằng cấu trúc quai mao mạch được quan sát trên nội soi thực quản (IPCL) đại diện cho một đặc điểm có thể nhìn thấy qua nội soi của u tân sinh tế bào vảy thực quản và những thay đổi hình thái có liên quan chặt chẽ đến độ sâu của sự xâm lấn của khối u ác tính. Việc phân loại IPCL dựa trên NBI do Hiệp hội Nội soi Nhật Bản đề xuất đã được sử dụng rộng rãi trong thực hành lâm sàng vì chúng dễ hiểu. Tuy nhiên, việc phân loại IPCL vẫn cần có đủ kinh nghiệm và việc giải thích vẫn mang tính chủ quan. Do đó, để phân loại IPCL một cách khách quan hơn và giúp các bác sĩ nội soi ít kinh nghiệm tận dụng được hết NBI thì việc kết hợp NBI với AI sẽ là giải pháp tốt.
Zhao và cộng sự đã phân tích hình ảnh NBI phóng đại và cho thấy rằng độ chính xác chẩn đoán của hệ thống CAD tốt hơn so với các nhà nội soi cấp cơ sở và trung cấp và không có sự khác biệt đáng kể giữa hệ thống này cùng các nhà nội soi cao cấp. Tuy nhiên, nghiên cứu này chỉ tập trung vào phân loại IPCL và không xác minh thêm tính chính xác của hệ thống xác định độ sâu xâm lấn của khối u. Đối với ESCC sớm, việc xác định chính xác độ sâu xâm lấn của khối u là tiền đề của việc lựa chọn phương pháp điều trị thích hợp. Nakagawa và cộng sự đã sử dụng hình ảnh nội soi không phóng đại để kiểm tra hệ thống CAD và nhận thấy rằng độ nhạy của hệ thống này để chẩn đoán ung thư biểu mô, dưới niêm mạc xâm lấn lên đến 200 μm (EP-SM1) cao hơn so với các chuyên gia nội soi, nhưng độ đặc hiệu thấp hơn. Không có sự khác biệt đáng kể giữa hệ thống và các chuyên gia nội soi dựa trên hình ảnh nội soi phóng đại.
Phân tích sâu hơn cho thấy hệ thống hoạt động tốt trong chẩn đoán ung thư khu trú ở lớp EP / lớp đệm (LPM) và không có sự khác biệt đáng kể so với các chuyên gia nội soi. Tuy nhiên, độ nhạy của hệ thống chẩn đoán u ở lớp cơ niêm (MM) / dưới niêm SM1 kém, cũng như hiệu suất của các chuyên gia nội soi. Trong chẩn đoán u xâm lấn đến lớp dưới niêm SM2 / 3, độ nhạy của hệ thống này cao hơn một chút so với các chuyên gia nội soi.
Tokai và cộng sự cũng sử dụng hình ảnh nội soi không phóng đại để phân tích và nhận thấy rằng độ nhạy của NBI cao hơn một chút so với WLE và hiệu suất chẩn đoán của hệ thống tốt hơn so với các chuyên gia nội soi. Phân tích sâu hơn cho thấy độ chính xác của hệ thống CAD trong chẩn đoán u xâm lấn đến các lớp biểu mô, màng đệm, cơ niêm EP / LPM và MM là hơn 90%, cao hơn đáng kể so với chẩn đoán u xâm lấn đến lớp dưới niêm SM1 và SM2. Nguyên nhân có thể là do bộ hình ảnh huấn luyện không chứa hình ảnh thực quản bình thường, và hệ thống đã nhầm lẫn sự nén ngoài khung và không mở rộng hoàn toàn thành thực quản với các đặc điểm tổn thương.
Lợi ích của trí tuệ nhân tạo trong bệnh lý loạn sản Barrett thực quản và ung thư biểu mô tuyến thực quản giai đoạn sớm đóng một vai trò rất quan trọng giúp mang đến chẩn đoán chính xác để từ đó có hướng điều trị phù hợp với từng tình trạng bệnh.
Chuyên khoa Nội tiêu hóa - Bệnh viện Đa khoa Quốc tế Vinmec đang phát triển các dịch vụ tầm soát và phát hiện sớm ung thư đường tiêu hóa kết hợp khám lâm sàng và cận lâm sàng nhằm đem lại kết quả chính xác nhất cho bệnh nhân, từ đó đưa ra hướng điều trị tích cực giúp người bệnh sớm kiểm soát tốt tình trạng sức khỏe.
Việc thăm khám tại bệnh viện không chỉ mang đến kết quả chẩn đoán, điều trị chính xác nhờ đội ngũ y bác sĩ có nhiều năm kinh nghiệm, kết hợp cùng hệ thống trang thiết bị hiện đại với máy nội soi NBI có gây mê. Xét nghiệm tổng phân tích tế bào máu ngoại vi (bằng máy đếm laser). Xét nghiệm thời gian prothrombin bằng máy tự động. Xét nghiệm thời gian thromboplastin một phần hoạt hoá (APTT: Activated Partial Thromboplastin Time) bằng máy tự động. Siêu âm ổ bụng tổng quát... mà bệnh viện còn có không gian khám vô cùng văn minh, lịch sự mang đến cảm giác thoải mái cho bệnh nhân.
Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.
Tài liệu tham khảo
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI]
- Hur C, Miller M, Kong CY, Dowling EC, Nattinger KJ, Dunn M, Feuer EJ. Trends in esophageal adenocarcinoma incidence and mortality. Cancer. 2013;119:1149-1158. [PubMed] [DOI]
- Thrift AP. The epidemic of oesophageal carcinoma: Where are we now? Cancer Epidemiol. 2016;41:88-95. [PubMed] [DOI]
- Lu-Ming Huang, Wen-Juan Yang, Zhi-Yin Huang, Cheng-Wei Tang, Jing Li, Artificial intelligence technique in detection of early esophageal cancer, World J Gastroenterol. Oct 21, 2020; 26(39): 5959-5969