Xuất huyết tiêu hóa trên (GI) là một thách thức lâm sàng đáng kể. Đáng chú ý là chảy máu từ vết loét tự dừng lại ở ít nhất 80% trường hợp mà không cần can thiệp cụ thể.
Bài viết được viết bởi ThS.BS Mai Viễn Phương - Bác sĩ nội soi tiêu hóa, Khoa Khám bệnh & Nội khoa - Bệnh viện Đa khoa Quốc tế Vinmec Central Park.
Tuy nhiên, tỷ lệ mắc chảy máu đường tiêu hóa trên (UGIB) hàng năm dao động từ 0,05% đến 1%, với một số bệnh nhân tử vong vì tình trạng này. Việc xử trí ban đầu thường bao gồm hồi sức và nội soi trong vòng 24 giờ, mặc dù lợi ích của nội soi rất sớm (< 12 giờ) đối với bệnh nhân có nguy cơ cao vẫn còn đang được tranh luận. Mục tiêu điều trị bao gồm ngăn chặn chảy máu cấp tính, ngăn ngừa chảy máu tái phát và sử dụng phương pháp tiếp cận đa phương thức bao gồm các phương pháp nội soi, dược lý, chụp mạch và phẫu thuật. Các tác nhân dược lý như vasopressin, prostaglandin và thuốc ức chế bơm proton có hiệu quả, nhưng việc sử dụng thuốc chống huyết khối ngày càng tăng đã làm tăng tỷ lệ mắc bệnh chảy máu tiêu hóa.
Điều trị ban đầu xuất huyết tiêu hóa
Quản lý ban đầu xuất huyết tiêu hóa thường bao gồm hồi sức và các quyết định tiếp theo liên quan đến các can thiệp điều trị. Các hướng dẫn hiện tại ủng hộ nội soi trong vòng 24 giờ đối với bệnh nhân bị UGIB. Liệu bệnh nhân có nguy cơ cao có được hưởng lợi nhiều hơn từ nội soi rất sớm (trong vòng 12 giờ) hay không vẫn còn là vấn đề gây tranh cãi. Các nghiên cứu đã chỉ ra rằng hồi sức dịch hạn chế (sử dụng thể tích dịch chậm hoặc nhỏ hơn) không thua kém các chiến lược hồi sức dịch tích cực hơn (bao gồm thể tích dịch sớm hoặc lớn hơn) về mặt tử vong.
Mục tiêu chính của điều trị xuất huyết tiêu hóa
Mục tiêu chính của điều trị xuất huyết tiêu hóa là hai mặt: Ngăn chặn các đợt chảy máu cấp tính và ngăn ngừa tái chảy máu. Để đạt được các mục tiêu này đòi hỏi một phương pháp tiếp cận đa phương thức bao gồm các liệu pháp nội soi, dược lý, chụp mạch và phẫu thuật. Nhiều tác nhân dược lý khác nhau, chẳng hạn như vasopressin, secretin, prostaglandin, somatostatin và thuốc ức chế bơm proton đã được sử dụng hiệu quả để kiểm soát xuất huyết tiêu hóa.
Tuy nhiên, các nghiên cứu cũng nhấn mạnh rằng tỷ lệ sử dụng các tác nhân dược lý kết hợp như thuốc chống huyết khối ngày càng tăng đã làm tăng tỷ lệ mắc bệnh do chảy máu tiêu hóa, cho thấy rằng can thiệp trực tiếp thường là điều cần thiết. Các liệu pháp chụp mạch, bao gồm bọt gel và vasopressin, đã được sử dụng, mặc dù chúng có khả năng dẫn đến các biến chứng, chẳng hạn như thiếu máu cục bộ, hẹp, nhồi máu, thủng và hình thành áp xe.
Cầm máu nội soi đã trở thành tiêu chuẩn chăm sóc được chấp nhận cho những cá nhân bị xuất huyết tiêu hóa trên cấp tính không do giãn tĩnh mạch
Các kỹ thuật như điện đông đơn cực, điện đông lưỡng cực và đầu dò nhiệt cũng đã được sử dụng. Mặc dù hiệu quả, điện đông đơn cực có thể gây tổn thương mô ở mức độ lớn hơn điện đông lưỡng cực, vốn là một nguồn lo ngại. Kỹ thuật này sử dụng một mạch điện duy nhất để làm nóng và cầm máu, đôi khi có thể gây hại cho các mô xung quanh. Tuy nhiên, điện đông lưỡng cực, sử dụng hai điểm điện để tạo ra nhiệt tập trung hơn và ít gây tổn thương hơn, và đầu dò nhiệt, đặc biệt hữu ích đối với tình trạng chảy máu động mạch < 2 mm, giải quyết được các yêu cầu của phần lớn bệnh nhân bị chảy máu loét.
Các chiến lược tiêm khác nhau
Các chiến lược tiêm khác nhau tùy thuộc vào tác nhân được sử dụng, với các cơ chế hoạt động có thể bao gồm co mạch, tác dụng chèn ép, gây kết tập tiểu cầu, xơ cứng, huyết khối và/hoặc làm khô mô. Một phương pháp tiếp cận sáng tạo liên quan đến việc sử dụng bột, cụ thể là Hemospray (HS, TC-325; Cook Medical, Bloomington, IN, Hoa Kỳ). Khi bột này tiếp xúc với máu, nó sẽ hấp thụ nước và cùng nhau tạo ra một rào cản cơ học bằng cách hoạt động kết dính và dính chặt để tạo thành một chèn ép cơ học.
Quá trình này giúp cầm máu hiệu quả. Bằng cách hấp thụ chất lỏng, HS tăng cường hình thành cục máu đông bằng cách làm biến dạng và đóng gói hồng cầu, tập trung tiểu cầu hoạt hóa với các yếu tố đông máu và tương tác với ma trận fibrin. Tuy nhiên, thời gian lưu trú của nó bị giới hạn ở mức 24 giờ hoặc ít hơn, và nó không thúc đẩy quá trình lành mô. Do đó, liệu pháp đơn trị TC-325 có thể không đủ để điều trị loét có vết thương có nguy cơ cao nhưng có thể hữu ích như một biện pháp tạm thời để ngăn chặn chảy máu. Trong những trường hợp như vậy, nên nội soi kiểm tra lại hoặc một kỹ thuật cầm máu bổ sung. Nhóm của chúng tôi chủ yếu sử dụng TC-325, đặc biệt là sau các thủ thuật như ESD, khi có chảy máu đáng kể hoặc khi độ sâu của vết loét sau thủ thuật cho thấy nguy cơ chảy máu chậm.
Endoclot
Endoclot (EC; Micro-Tech Europe, Düsseldorf, Đức) được tạo thành từ các hợp chất có nguồn gốc từ tinh bột bao gồm polysaccharides cầm máu có thể hấp thụ. Tương tự như Hemospray, khi tiếp xúc với máu, EC khởi tạo quá trình mất nước dẫn đến sự cô đặc của các yếu tố đông máu, tiểu cầu và hồng cầu, do đó đẩy nhanh quá trình đông máu sinh lý và hình thành lớp vỏ cơ học của ma trận gel bám vào mô chảy máu.
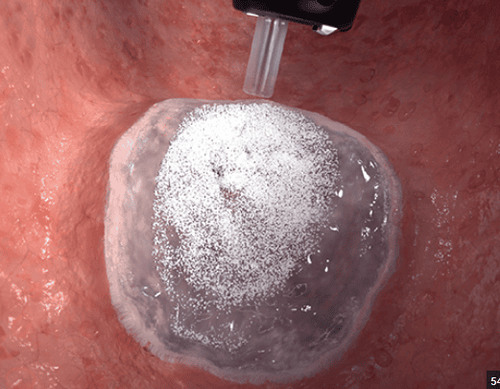
Hiện nay, liệu pháp điều trị đầu tay cho chảy máu đường tiêu hóa liên quan đến loét bao gồm sử dụng đầu dò nhiệt và kẹp qua ống soi có hoặc không sử dụng kết hợp tiêm epinephrine dưới niêm mạc. Tuy nhiên, có những hạn chế trong việc cầm máu trong quá trình xuất huyết đang hoạt động, đặc biệt là trong các trường hợp loét xơ hóa lớn và/hoặc có tổn Thương lõm ở những vị trí khó khăn về mặt giải phẫu.
Gần đây, kẹp qua ống soi (OTSC) đã nổi lên như một giải pháp thay thế đầy hứa hẹn. Những kẹp cỡ lớn hơn này, được làm bằng nitinol, một loại kim loại được biết đến với hiệu ứng nhớ hình dạng và độ đàn hồi cao, cho phép đóng áp suất cao các vùng niêm mạc lớn hơn. OTSC bắt giữ các lớp mô sâu hơn và có thể tăng cường cầm máu. Với các phát hiện phân tích tổng hợp cho thấy OTSC làm giảm chảy máu tái phát trong 30 ngày ở UGIB, việc sử dụng chúng đã tăng lên.
Công cụ Gold Probe
Công cụ Gold Probe (Microvasive, Boston, MA, Hoa Kỳ) đại diện cho một bước tiến đáng kể trong lĩnh vực nghiên cứu này. Đầu dò này kết hợp điện đông lưỡng cực với cơ chế tiêm bên trong, khiến nó đặc biệt hữu ích để nhắm mục tiêu vào các vị trí đông máu cụ thể. Khi được đặt vuông góc với niêm mạc, đầu dò ở mức 20 W và 40 W trong thời gian dưới 6 giây đã gây ra tình trạng đông máu giới hạn ở lớp niêm mạc, trong khi ở mức 9 giây, tình trạng đông máu dưới niêm mạc xảy ra và ở mức 80 W trong hơn 15 giây, tình trạng đông máu mở rộng đến lớp cơ. Thiết kế của đầu dò vàng nhằm mục đích giảm tình trạng xoắn, do đó tạo điều kiện thuận lợi cho việc tiến triển của nó và cung cấp khả năng chèn ép trực diện và tiếp tuyến tốt hơn.
Việc tích hợp tiêm và cầm máu nhiệt vào một ống thông duy nhất nhằm mục đích giảm việc thay ống thông và thời gian thực hiện thủ thuật. Khoảng cách chính xác giữa các cặp điện cực giúp kiểm soát độ sâu của quá trình đông máu và đầu xa tròn được thiết kế để tạo điều kiện cho quá trình đông máu hiệu quả ở nhiều vị trí đầu khác nhau. Tuy nhiên, vẫn có một số vấn đề phát sinh với đầu dò vàng, đặc biệt là khi sử dụng có hoặc không có quá trình tiêm, bao gồm cung cấp năng lượng, sau đó là tách vật liệu, gãy đầu dò, hồ quang, thiếu linh kiện, đầu dò bị cong và thiết bị bị tách ra.
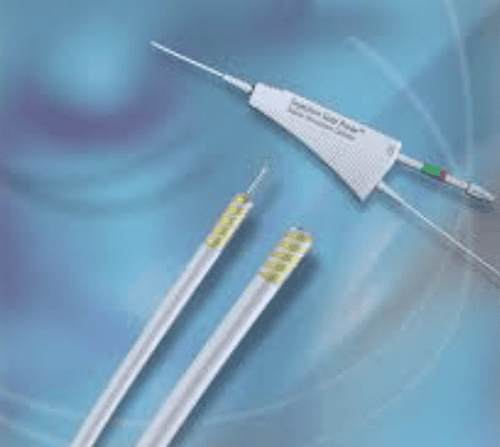
Với những vấn đề thường gặp liên quan đến thiết bị này, việc sử dụng Gold Probe, ngay cả khi không có tác dụng phụ đối với bệnh nhân, có thể không được khuyến khích. Trong liệu pháp cầm máu nội soi, hai biến chứng chính, tức là chảy máu không kiểm soát được và thủng tạng, là rất hiếm; tuy nhiên, khả năng xảy ra của chúng phải được cân nhắc trong mọi trường hợp.
Hướng đi tương lai cho sự tiến bộ trong các kỹ thuật cầm máu liên quan đến việc đánh giá sự kết hợp của các phương pháp khác nhau về tính an toàn và hiệu quả của chúng
Một nghiên cứu đã khám phá một kỹ thuật kết hợp thông thường bao gồm tiêm adrenaline nước muối theo sau là ứng dụng đầu dò làm nóng. Phương pháp này bao gồm tiêm adrenaline nước muối, sau đó là ứng dụng đầu dò làm nóng vào vết loét tại vị trí mạch máu có thể nhìn thấy. Các xung năng lượng tiếp theo lên đến 30 J được truyền cho đến khi mạch máu hoàn toàn phẳng hoặc bị cắt bỏ. Phương pháp này vượt trội hơn liệu pháp đơn trị TC-325. Một chiến lược tiềm năng bao gồm việc áp dụng TC-325 nhiều lần trong vài ngày đầu tiên sau một kỹ thuật kết hợp thông thường.
Hơn nữa, sự kết hợp của OTSC với nhiều công cụ cầm máu khác nhau đáng được nghiên cứu thêm để xác định hiệu quả của chúng. Những tiến bộ trong các kỹ thuật hình ảnh nội soi là rất quan trọng để kiểm soát chảy máu chính xác và hiệu quả hơn. Ví dụ, sự ra đời gần đây của mô hình nội soi Olympus X1500 và việc sử dụng hình ảnh chẩn đoán nhanh (RDI) là một bước tiến nhanh hơn trong việc xác định các vị trí chảy máu. Tuy nhiên, vẫn chưa có sự đồng thuận hoàn toàn về chẩn đoán và điều trị xuất huyết, điều này nhấn mạnh nhu cầu nghiên cứu liên tục để phát triển các chỉ định và phương pháp chuẩn hóa và định lượng.
Kết luận
Cầm máu nội soi, đặc biệt đối với chảy máu đường tiêu hóa không do giãn tĩnh mạch, sử dụng các kỹ thuật như điện đông và đầu dò nhiệt, với mối lo ngại về tổn thương mô do điện đông đơn cực. Các phương pháp mới như Hemospray và Endoclot cho thấy triển vọng trong việc tạo ra các biện pháp chèn ép cơ học nhưng có những hạn chế.
Hiện nay, liệu pháp điều trị đầu tay bao gồm đầu dò nhiệt và kẹp cầm máu, với các kẹp cầm máu ngoài ống nội soi đang xuất hiện đối với chảy máu loét lớn hơn. Công cụ Gold Probe, kết hợp điện đông lưỡng cực và tiêm, cung cấp khả năng đông máu có mục tiêu nhưng đã gặp phải các vấn đề liên quan đến thiết bị. Những tiến bộ trong tương lai bao gồm kết hợp các kỹ thuật và cải thiện hình ảnh nội soi, với các nghiên cứu khám phá các phương pháp kết hợp cho thấy triển vọng.
Tài liệu tham khảo
1. Hansen ML, và công sự. Risk of bleeding with single, dual, or triple therapy with warfarin, aspirin, and clopidogrel in patients with atrial fibrillation. Arch Intern Med. 2010;170:1433-1441.
2. Rockey DC. Gastrointestinal bleeding. Gastroenterol Clin North Am. 2005;34:581-588.
3. Lee AY, Cho JY. Advancements in hemostatic strategies for managing upper gastrointestinal bleeding: A comprehensive review. World J Gastroenterol 2024; 30(15): 2087-2090