Bài viết được viết bởi TS. Hoàng Minh Đức - Trưởng nhóm Dự án sản xuất thử nghiệm, Viện nghiên cứu Tế bào gốc và Công nghệ gen Vinmec
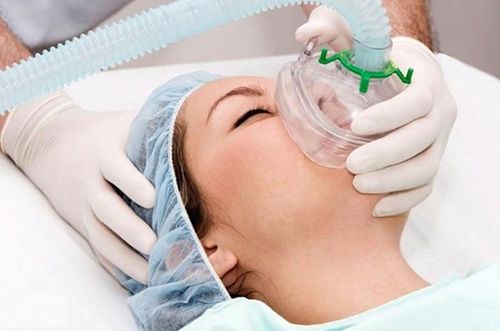
Theo tiêu chuẩn Berlin 2012 cho phép chia ARDS thành các mức độ nhẹ vừa và nặng. Đồng thời Hội nghị cũng đưa ra các khuyến cáo điều trị tương ứng với các mức độ nặng của bệnh, bao gồm các chiến lược thông khí nhân tạo, sử dụng các thuốc an thần, giãn cơ và các biện pháp điều trị hỗ trợ khác.
1. Điều trị hội chứng suy hô hấp cấp do nhiễm virus COVID-19
Thông khí nhân tạo không xâm nhập được xem xét chỉ định cho các bệnh nhân ARDS ở mức độ nhẹ. Thông khí nhân tạo theo chiến lược bảo vệ phổi vẫn là biện pháp thông khí chủ đạo cho các mức độ của ARDS. Chiến lược này cần kết hợp với PEEP thấp đến trung bình ở bệnh nhân ARDS nhẹ hoặc với PEEP ở mức trung bình đến cao đối với bệnh nhân ARDS vừa và nặng.
Thông khí nhân tạo tần số cao (HFO) và thông khí nhân tạo tư thế nằm sấp được chỉ định cho các bệnh nhân ARDS nặng và thất bại với thông khí thông thường. Thuốc giãn cơ khi thở máy được cân nhắc chỉ định cho bệnh nhân ARDS nặng. Trao đổi khí bằng tuần hoàn ngoài cơ thể (ECMO) chỉ được chỉ định hạn chế ở những bệnh nhân ARDS nặng và thất bại với các biện pháp điều trị trước đó.
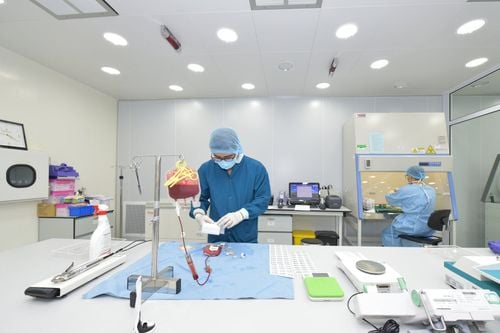
2. Liệu pháp ghép tế bào gốc
Tế bào gốc có khả năng thay thế những tế bào trong cơ thể, bao gồm tế bào phổi, mạch máu, biểu mô. Những tế bào chưa biệt hóa này sẽ giúp cơ thể sửa chữa tổn thương, thay thế tế bào hư hỏng bằng tế bào mới và điều hòa hệ thống miễn dịch, giảm quá trình viêm đã được khởi phát.

Trong một số mô hình động vật bị ARDS và COPD, truyền tế bào gốc trung mô (TBGTM) ở người có nguồn gốc từ tủy xương, mô mỡ hoặc mô dây rốn đã làm giảm mức độ nghiêm trọng của tình trạng bệnh và phục hồi các chức năng của phổi.
Một báo cáo sử dụng mô hình chấn thương phổi cấp 24h do viêm phổi do vi khuẩn ở cừu đã chứng minh sự cải thiện oxy và giảm dịch phổi ngoài mạch máu ở nhóm ghép TBGTM so với nhóm đối chứng mà không có bất kỳ tác dụng phụ nào.
Hơn nữa, các liệu pháp điều trị dựa trên TBGTM đã chứng minh hiệu quả đầy hứa hẹn trong điều trị ARDS thử nghiệm thông qua ức chế sự sụp đổ phế nang, tích lũy collagen và chất ức chế chết rụng tế bào trong mô phổi.
Một nghiên cứu cũng đã cho thấy ghép TBGTM đồng loại trên 9 bệnh nhân ARDS không xảy ra biến cố nghiêm trọng nào như thiếu máu, viêm phổi. Gần đây, Matthay và các đồng nghiệp đã tiến hành một thử nghiệm ngẫu nhiên, mù đôi, đa trung tâm, ngẫu nhiên để đánh giá điều trị TBGTM có nguồn gốc từ tủy xương ghép đồng loại trên bệnh nhân thở máy với ARDS từ trung bình đến nặng.
Các kết quả đã xác nhận rằng ghép TBGTM là an toàn và do khả năng tồn tại thấp của các sản phẩm TBGTM cần phải thực hiện các thử nghiệm lớn hơn để đánh giá hiệu quả điều trị.
Một thử nghiệm lâm sàng giai đoạn II đa trung tâm, mù đôi và giả dược (NCT00683722) áp dụng liệu pháp ghép TBGTM ở bệnh nhân COPD từ trung bình đến nặng được thực hiện từ năm 2008 đến 2010 tại Hoa Kỳ.
Kết quả cho thấy trong 2 năm tiếp theo của thử nghiệm, không biến cố bất lợi nghiêm trọng nào được quan sát thấy sau ghép TBG. Một nghiên cứu lâm sàng khác (NCT01110252) được thực hiện ở Brazil sử dụng tế bào đơn nhân tủy xương tự thân (BMMNCs) ở bệnh nhân COPD đã được thực hiện từ năm 2009 đến năm 2011.

Kết quả của thử nghiệm lâm sàng này cũng cho thấy sự an toàn của liệu pháp tế bào gốc vì không có tác dụng phụ nào được báo cáo liên quan đến cấy ghép TBG. Jiaji (2020) đã công bố kết quả sử dụng TBGTM điều trị 17 bệnh nhân bị ARDS do nhiễm H7N9 so sánh với 44 bệnh nhân làm nhóm chứng. Kết quả cho thấy tỷ lệ tử vong giảm xuống còn 17.6% trong nhóm ghép TBG trong khi nhóm chứng là 54.5%.
Trong số các tế bào gốc trung mô thì tế bào gốc trung mô có nguồn gốc từ dây rốn là ưu việt hơn cả. Tế bào này có thể được phân lập từ toàn bộ các phần của dây rốn hay từ những bộ phận riêng lẻ cấu thành của dây rốn như các tế bào TBGTMDR lấy từ động mạch và tĩnh mạch, màng dây rốn và lấy từ khối nhầy WJ.
Theo các nghiên cứu so sánh tốc độ tăng sinh giữa các dòng tế bào trung mô khác nhau thì tế bào gốc trung mô từ dây rốn có khả năng tăng sinh cao hơn tế bào trung mô từ tủy xương – dòng tế bào được cho là tiêu chuẩn vàng để so sánh các tế bào gốc trung mô hay tế bào gốc trung mô từ mô mỡ hoặc từ các những nguồn nhau thai.
Giá trị trung bình của thí nghiệm tạo cụm (CFU – colony forming unit) trên 1x106 tế bào có nhân cho thấy VICELL 1 có khả năng tạo ra từ 300 đến 2000 cụm tế bào trung mô trên 1x106 tế bào có nhân, cao hơn rất nhiều lần tế bào trung mô từ tủy xương (khoảng từ 16-64 cụm trên 1x106 tế bào có nhân).
Một số nghiên cứu về kỹ thuật can thiệp Gene cho thấy TBGTM dây rốn vẫn duy trì khả năng biệt hoá sau khi thực hiện các kỹ thuật thay đổi genes hay sau khi chuyển các đoạn Gene vào bên trong tế bào bằng phương pháp hoá học, sinh học hay cơ học. TBGTM dây rốn mang đoạn Gene kích hoạt quá trình tạo ra hepatocyte growth factor (HGF) có thể biệt hoá một cách dễ dàng thành các dopaminergic neuron với khả năng tạo ra dopamine, tyrosine hydroxylase và một số protein vận chuyển dopamine. Những tế bào này còn có khả năng kích thích quá trình tự tái tạo các tế bào thần kinh khi được cấy truyền vào chuột.
Cả 2 dòng tế bào gốc trung mô từ dây rốn và từ tủy xương cũng đều được sử dụng để đánh giá mật độ biểu hiện HLA trên bề mặt của tế bào, các tác nhân kích thích hệ miễn dịch và các phân tử tham gia vào quá trình giảm phản ứng miễn dịch.
Kết quả cho thấy, biểu hiện Gene của các phân tử MHCII (bao gồm HLA-DMA, -DRA, và –DPB1) ở các tế bào gốc trung mô từ tủy xương lần lượt cao hơn gấp 16 lần, 36 lần và 3 lần khi so sánh với tế bào gốc trung mô từ dây rốn. Việc hoạt hoá các genes liên quan đến miễn dịch (bao gồm TLR4, TLR3, JAG1, NOTCH2, và NOTCH 1) ở các tế bào trung mô từ tủy xương cao hơn từ 4 đến 38 lần khi so sánh với TBGTM dây rốn.
Những kết quả nghiên cứu này củng cố thêm cho các nghiên cứu về khả năng kích ứng miễn dịch của TBGTM dây rốn và củng cố thêm cơ sở dữ liệu cho thấy rằng TBGTM dây rốn là dòng tế bào gốc trung mô có khả năng kích ứng miễn dịch thấp nhất trong những dòng tế bào gốc trung mô hiện hữu.
Lý do đầu tiên của khả năng điều hoà miễn dịch liên quan trực tiếp đến khả năng giảm kích ứng phản ứng miễn dịch, kể cả trong trường hợp dị ghép, do các tế bào gốc trung mô nói chung và TBGTM dây rốn nói riêng không có hoặc có rất ít các HLA-DR và phân tử MHC-Class I trên bề mặt của tế bào.
Hơn thế nữa, các TBGTM dây rốn không sản xuất ra CD80 và CD86 proteins, hai proteins có vai trò quan trọng trong việc kích hoạt tế bào miễn dịch T và các tế bào bạch cầu T khác.
Trên thế giới, FDA đã cho phép thực hiện các thí nghiệm lâm sàng (từ phase 1-3) để đánh giá tính an toàn và hiệu quả của việc sử dụng TBGTM dây rốn trong điều trị các bệnh lý lâm sàng. Theo trang web clinicaltrial.gov, TBGTM dây rốn đã được ứng dụng để điều trị trên 374 loại bệnh khác nhau từ các bệnh như rối loạn chuyển hóa, rối loạn hệ miễn dịch cho đến các bệnh như Alzheimer, chấn thương thần kinh, bệnh lý liên quan đến tim mạch.
(Theo thống kê của Clinicaltrial.gov, https://clinicaltrials.gov/) với hơn 115 nghiên cứu độc lập trên toàn thế giới. Tuy nhiên, chỉ có một số ít các nghiên cứu trên được báo cáo và có kết quả.
Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.