Bài viết được viết bởi Bác sĩ Hoàng Quốc Chính - Viện nghiên cứu Tế bào gốc và Công nghệ gen - Bệnh viện Đa khoa Quốc tế Vinmec Times City
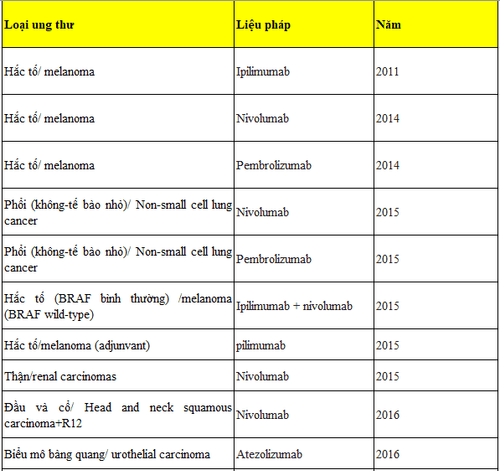
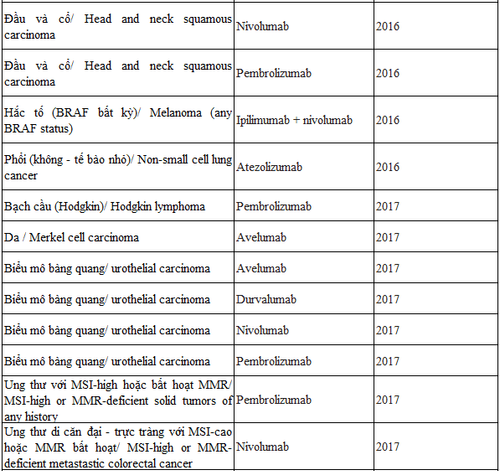
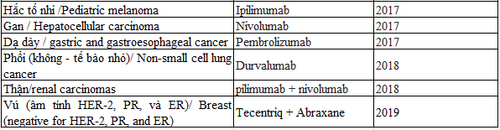
Tính đến nay, Cơ quan Quản lý và Dược phẩm Hoa Kỳ (FDA) đã cấp phép cho 8 liệu pháp ức chế chốt kiểm soát miễn dịch trong điều trị một số bệnh ung thư bao gồm ung thư phổi, đại - trực tràng, gan, vú, và đầu cổ. Danh sách này sẽ tiếp tục được kéo dài ra trong tương lai gần vì các thử nghiệm lâm sàng về liệu pháp ức chế chốt kiểm miễn dịch vẫn tiếp tục triển khai trên toàn thế giới.
1. Khái quát chung về liệu pháp ức chế chốt kiểm miễn dịch
Liệu pháp ức chế chốt kiểm miễn dịch (checkpoint inhibitor therapies) là liệu pháp giải phóng ức chế miễn dịch thông qua loại bỏ tín hiệu ức chế hoạt hóa/hoạt động của tế bào T. Khi được hoạt hóa bởi kháng nguyên “lạ” (antigen) và tín hiệu đồng hoạt hóa (costimunatory signal), tế bào T phân chia để tạo ra hàng triệu tế bào T đặc hiệu kháng nguyên. Những tế bào T đặc hiệu kháng nguyên này tiết ra cytokine, interferon, và tham gia vào quá trình tiêu diệt chủ động (active killing) để loại bỏ tác nhân gây bệnh.
Điểm mấu chốt của một hệ miễn dịch hiệu quả là khả năng phân biệt được tác nhân gây bệnh với tế bào bình thường của cơ thể, và chỉ tấn công những tế bào “lạ”. Để có thể phân biệt được tế bào “lạ” với tế bào bình thường trong cơ thể, tế bào T phải vượt qua hai quá trình chọn lọc là dung nạp trung tâm (central tolerance) và dung nạp ngoại vi (peripheral tolerance). Dung nạp trung tâm diễn ra trong tuyến ức khi tiền tế bào T (immature T cells) phân chia để tạo ra một lượng lớn tế bào T. Các đoạn gen mã hóa cho thụ thể tế bào T (TCR - T cell receptors) của những tế bào T này cũng được tái tổ hợp để tạo ra các TCR có thể nhận diện tất cả các kháng nguyên mà các tế bào T có thể gặp phải. Tế bào T tương tác mạnh với các phức hệ phù hợp mô chính (MHC) mang kháng nguyên của tế bào bản thể (self-peptides) sẽ bị loại bỏ để tránh phản ứng tự miễn (Tế bào T tấn công các tế bào bình thường của cơ thể). Quá trình dung nạp trung tâm cũng loại bỏ những tế bào T không tương tác với MHC và chỉ giữ lại những tế bào T có tương tác yếu MHC. Những tế bào T được lựa chọn sau quá trình dung nạp trung tâm sẽ được tuần hoàn để tham gia vào quá trình dung nạp ngoại vi.
Dung nạp ngoại vi bao gồm việc phát triển hàng loạt cơ chế kiểm soát miễn dịch nghĩa là ức chế quá trình hoạt hóa và/hoặc hoạt động của tế bào T, nhằm đảm bảo quá trình tự miễn sẽ không xảy ra. CTLA-4 (cytotoxic T lymphocyte-associated antigen 4) và PD-1 (program death 1) là hai con đường kiểm soát miễn dịch được nghiên cứu nhiều nhất. Những kiến thức về cơ chế ức chế miễn dịch của CTLA-4 và PD-1, cũng như những bằng chứng tiền lâm sàng về tính kháng ung thư của chất ức chế CTLA-4 và PD-1 đã đặt nền tảng khoa học cho việc phát triển liệu pháp ức chế chốt kiểm miễn dịch trong điều trị ung thư.
Tính đến nay, Cơ quan Quản lý và Dược phẩm Hoa Kỳ (FDA) đã cấp phép cho 8 liệu pháp ức chế chốt kiểm miễn dịch trong điều trị một số bệnh ung thư bao gồm ung thư phổi, đại - trực tràng, gan, vú, và đầu cổ (chi tiết ở bảng 1). Danh sách này sẽ tiếp tục được kéo dài ra trong tương lai gần vì các thử nghiệm lâm sàng về liệu pháp ức chế chốt kiểm miễn dịch vẫn tiếp tục triển khai trên toàn thế giới.
Bài viết này sẽ trình bày khái quát về cơ chế ức chế miễn dịch, cơ chế giải phóng miễn dịch của chất ức chế chốt kiểm miễn dịch trong điều trị ung thư, và các chỉ thị sinh học giúp lựa chọn bệnh nhân cho liệu pháp này, nhằm cung cấp những kiến thức cơ sở về liệu pháp ức chế miễn dịch.
Bảng 1: Danh sách thuốc ức chế chốt kiểm miễn dịch được FDA cấp phép
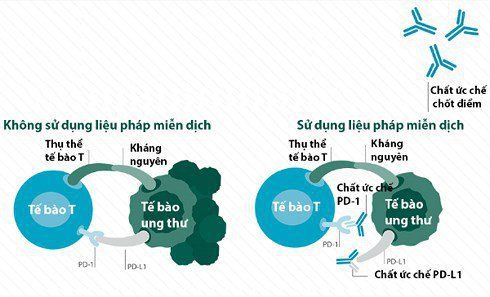
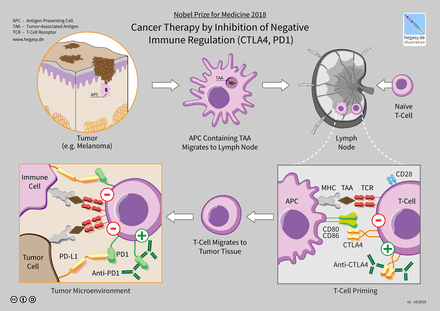
2. Cơ chế ức chế chốt kiểm soát miễn dịch qua thụ thể CTLA-4 và PD-1
2.1. Hoạt hóa tế bào T
Tế bào T được sản sinh trong tuyến ức và được lập trình để nhận ra các tác nhân gây bệnh. Sau khi rời tuyến ức, tế bào T đi vào hệ tuần hoàn và thường “dừng chân” tại các hạch bạch huyết nơi có chứa nhiều kháng nguyên lạ được trình diện bởi tế bào trình diện kháng nguyên (APC – Antigen presenting cell). Khi TCR của tế bào T tương tác với phức hệ MHC - kháng nguyên lạ trên tế bào trình diện kháng nguyên, quá trình hoạt hóa được khởi động. Quá trình nhận diện kháng nguyên bắt đầu bằng việc “nuốt” những mảnh vỡ của tế bào ung thư bởi các tế bào trình diện kháng nguyên. Bên trong tế bào APC, các phân mảnh của tế bào ung thư sẽ bị phân hủy để tạo ra các đoạn peptide ngắn. Các peptide này (kháng nguyên) sẽ được trình diện trên bề mặt tế bào APC ở dạng phức hợp với MHC để được thụ thể TCR của tế bào T nhận diện. Sau khi TCR tương tác với phức hợp “MHC-kháng nguyên”, thì thụ thể CD4 của tế bào T hỗ trợ (CD4+ T helper Cell) hoặc CD8 của tế bào T độc (Cytotoxic T cell) cũng liên kết với MHC để tạo một liên kết bền vững giữa tế bào T và APC. Bên cạnh việc nhận diện kháng nguyên, tế bào T còn cần được kích hoạt bởi tín hiệu đồng hoạt hóa (costimunatory signals) để có thể tạo ra được dòng tế bào T có khả năng nhận diện kháng nguyên đặc hiệu và tiêu diệt tế bào biểu hiện các kháng nguyên này. Hệ thống tín hiệu đồng hoạt hóa khuếch đại tín hiệu hoạt hóa của TCR khi nó tương tác với kháng nguyên lạ, do đó thúc đẩy quá trình hoạt hóa diễn ra hiệu quả hơn.
Với tế bào T hỗ trợ (Helper T Cells), thụ thể CD28 là phân tử chủ yếu của tín hiệu đồng hoạt hóa. Khi CD28 trên tế bào T hỗ trợ tương tác với thụ thể B7.1 (CD80) hoặc B7.2 (CD86) trên bề mặt tế bào APC, thì tế bào T bắt đầu phân chia để tạo ra hàng triệu tế bào T đặc hiệu kháng nguyên và sản xuất các tác nhân cần thiết cho việc loại bỏ tác nhân gây bệnh. Chỉ khi TCR và CD28 của tế bào T lần lượt tương tác với phức hợp kháng nguyên-MHC và B7 trên bề mặt tế bào APC, quá trình hoạt hóa tế bào T mới được kích hoạt. Khác với tế bào T hỗ trợ, tế bào T độc (Cytotoxic T Cell) không phụ thuộc nhiều vào phân tử CD28 nhưng phụ thuộc vào thụ thể CD70 và 4-1BB (CD137) cho quá trình hoạt hóa. Sau khi được hoạt hóa, tế bào T sẽ biểu hiện những gen cần thiết cho sự tồn tại của mình và rời khỏi hạch bạch huyết để xâm nhập vào khối u. Tại đây, các tế bào T chức năng (effector T cells) sẽ nhận diện tế bào ung thư và tiêu diệt chúng bằng cách tiết ra các cytokine, interferon, và các enzyme kích thích quá trình tự tiêu của tế bào. Bên cạnh việc thúc đẩy sự phân chia và biệt hóa của tế bào T, quá trình hoạt hóa tế bào T cũng kích thích sự biểu hiện của các con đường ức chế miễn dịch để đảm bảo rằng tế bào T chỉ tấn công các tác nhân gây bệnh chứ không làm hại đến các tế bào bình thường của cơ thể.
2.2. Kiểm soát miễn dịch qua thụ thể CTLA-4
Tín hiệu ức chế miễn dịch đầu tiên đươc mô tả là thụ thể CTLA-4. CTLA-4 có cấu trúc tương đồng với CD28, nhưng có ái lực với B7 trên bề mặt APC cao hơn CD28, nên nó cạnh tranh với tín hiệu đồng hoạt hóa bằng cách ngăn cản tương tác B7-CD28, do đó ức chế quá trình hoạt hóa của tế bào T. Thêm vào đó, một vài nghiên cứu đã chỉ ra rằng tương tác của CTLA-4 với B7 còn tạo ra tín hiệu ức chế quá trình hoạt hóa tế bào T. Thông qua việc cạnh tranh phối tử với thụ thể đồng hoạt hóa (CD28) và tạo ra tín hiệu ức chế hoạt hóa, CTLA-4 đóng vai trò quan trọng trong việc kiểm soát quá trình hoạt hóa tế bào T. Chức năng kiểm soát miễn dịch của CTLA-4 được củng cố thêm bởi thực tế rằng chuột không có gen ctla-4 sẽ sản sinh quá nhiều tế bào lympho và không sống quá 3-4 tuần tuổi.
CTLA-4 tăng mức độ biểu hiện ngay khi TCR nhận diện phức hợp MHC-kháng nguyên lạ và đạt mức tối đa sau khi tế bào T được hoạt hóa hai hoặc ba ngày. Bên cạnh việc tăng mức độ biểu hiện của CTLA-4, tế bào T “hoạt hóa” còn “điều chuyển” CTLA-4 từ tế bào chất tới vùng tiếp nhận miễn dịch (immunigic synapse) của tế bào T. Mức độ tập trung của CTLA-4 ở vùng tiếp nhận miễn dịch tỷ lệ thuận với mức độ hoạt hóa của tế bào T (tế bào T càng hoạt hóa thì càng có nhiều CTLA-4 ở vùng tiếp nhận miễn dịch). Khi số lượng phức hợp CTLA-4:B7 ở vùng tiếp nhận miễn dịch vượt xa số lượng phức hợp CD28:B7 thì quá trình hoạt hóa tế bào T bị ức chế hoàn toàn, do đó loại bỏ đáp ứng miễn dịch của tế bào T.
CTLA-4 cũng được chỉ ra là cần thiết cho chức năng ức chế miễn dịch của tế bào T kiểm soát (regulatory T cell). Tế bào T “kiểm soát” có vai trò quan trọng trong dung nạp miễn dịch ngoại vi và chức năng của chúng bị ảnh hường khi thiếu CTLA-4. Một trong những cơ chế ức chế miễn dịch của tể bào T “kiểm soát” là làm giảm sự biểu hiện của phân tử B7 trên bề mặt tế bào APC, do đó làm giảm tín hiệu đồng hoạt hóa thông qua thụ thể CD28 của tế bào T.
2.3. Kiểm soát miễn dịch qua thụ thể PD-1
Tiếp theo CTLA-4, PD-1 là thụ thể ức chế miễn dịch thứ hai được xác định. Chức năng sinh học chủ yếu của thụ thể PD-1 là để duy trì dung nạp ngoại vi và kiểm soát hoạt động của tế bào T trong vùng sinh lý cho phép. Hệ thống kiểm soát miễn dịch PD-1/PD-L1 được kích hoạt bởi quá trình đáp ứng miễn dịch nhằm giảm phản ứng quá mẫn của tế bào T. PD-1 chỉ biểu hiện trên bề mặt tế bào T đã hoạt hóa trong khi phối tử (PD-L1 và PD-L2) của nó được biểu hiện ở các tế bào trong khối u dưới tác động của các cytokine và interferon do tế bào T đã hoạt hóa tiết ra.
Tương tác của phối tử PD-L với thụ thể PD-1 sẽ truyền tín hiệu ức chế miễn dịch cho tế bào T, do đó dẫn đến trạng thái “bất hoạt” của tế bào T (exhausted T cell). Giống như CTLA-4, PD-1 cũng ức chế hoạt động của tế bào T thông qua giảm tín hiệu đồng hoạt hóa của thụ thể CD28, nhưng PD-1 không cạnh tranh với CD28 về tương tác với phối tử B7, mà nó ức chế hoạt tính của thụ thể CD28. CTLA-4 kiểm soát quá trình hoạt hóa của tế bào T ở hệ bạch huyết, nhưng PD-1 kiểm soát hoạt động của tế bào T hoạt hóa ở mô ngoại biên. Vai trò của thụ thể PD-1 trong kiểm soát miễn dịch được thể hiện rõ thông qua việc mắc bệnh tự miễn (autoimmunity) của những động vật không có gen Pdcd-1 (gen mã hóa cho PD-1) và người mang thể đột biến của gen này. Thêm vào đó, con đường PD-1/PD-L1 cũng được cho là có vai trò trong việc điều khiển quá trình thâm nhập của tế bào T vào trong khối u, do đó ngăn cản sự tiếp xúc trực tiếp của tế bào T hoạt hóa và tế bào ung thư.
3. Cơ chế điều trị ung thư của liệu pháp ức chế CTLA-4 và PD-1/PD-L1
Những hiểu biết về cơ chế ức chế miễn dịch của con đường CTLA-4 và PD-1, cũng như kết quả nghiên cứu tiền lâm sàng về tính kháng ung thư và tăng thời gian sống của động vật mô hình cho bệnh ung thư của chất ức chế CTLA-4 và PD-1 đã đặt nền tảng khoa học cho việc phát triển liệu pháp ức chế chốt kiểm soát miễn dịch. Một số kháng thể đơn dòng (monoclonal antibody) ức chế hoạt động của con đường CTLA-4 và PD-1 đã được Cơ quan Quản lý Dược phẩm Hoa Kỳ cấp phép cho điều trị một số loại ung thư (bảng 1), và đang được thử nghiệm trên những bệnh ung thư khác. Mặc dù cơ chế tác động của các chất ức chế CTLA-4 và PD-1/PD-L1 vẫn chưa hoàn toàn được làm sáng tỏ, mô hình hiện tại cho rằng chất ức chế CTLA-4 tác động vào tế bào T ở giai đoạn hoạt hóa diễn ra ở hạch bạch huyết trong khi chất ức chế PD-1/PD-L1 tác động vào tế bào T đã được hoạt hóa ở trong khối u.
Cơ chế giải phóng miễn dịch chủ yếu của chất ức chế CTLA-4 là thông qua việc ngăn chặn tương tác của thụ thể CTLA-4 với phối tử B7, do đó cho phép tế bào T tiếp tục được hoạt hóa thông qua con đường B7/CD28. Cấu trúc không gian của hỗn hợp CTLA-4 với ipilimumab, một kháng thể gắn CTLA-4, cho thấy ipilimumab tương tác trực tiếp với CTLA-4 ở vị trí mà B7 dùng để bám vào CTLA-4. Điều này ám chỉ rằng ipilimumab đã khóa vị trí tương tác của CTLA-4 với B7, do đó đã ngăn chặn sự ức chế của quá trình hoạt hóa của tế bào T [10]. Những bằng chứng gần đây cho thấy chất ức chế thụ thể CTLA-4 làm tăng số lượng tế bào T độc đặc hiệu cho kháng nguyên của tế bào ung thư, chứ không chỉ làm tăng số lượng tế bào T nói chung. Chất ức chế thụ thể CTLA-4 cũng làm giảm chức năng ức chế của tế bào T “kiểm soát”, vì vậy làm tăng tính kháng ung thư của tế bào T. Một cách ngắn gọn, chất ức chế thụ thể CTLA-4 làm tăng tính kháng ung thư của tế bào T thông qua quá trình “loại bỏ” ức chế miễn dịch.
Chất ức chế con đường PD-1/PD-L1 có khả năng loại bỏ khối u thông qua việc tái hoạt hoá tế bào T độc, qua đó làm tăng hoạt động cũng như tỷ lệ tế bào T độc. Ức chế thụ thể PD-1 giải phóng quá trình ức chế miễn dịch của tế bào T “bất hoạt” (exhausted T cells), do đó cho phép tế bào T “bất hoạt” được tái hoạt hóa và tăng hiệu quả của hệ miễn dịch bất chấp sự hiển diện của PD-L trong khối u. Bằng chứng nghiên cứu lâm sàng cho thấy chất ức chế PD-1/PD-L hoạt động hiệu quả nhất với những khối u đã có tế bào T độc hoạt hóa, nhưng bị ức chế bởi con đường PD-1/PD-L1. Tuy nhiên đáp ứng miễn dịch cũng được ghi nhận ở một số khối u không có sự biểu hiện của phối tử của PD-1 là PD-L1 hay PD-L2. Tính kháng ung thư của chất ức chế PD-1/PD-L1, cũng đòi hỏi sự có mặt của tế bào T hỗ trợ. Mặc dù chất ức chế PD-1/PD-L1 đã dành được nhiều sự quan tâm và nghiên cứu, nhưng cơ chế kháng ung thư của chúng vẫn chưa hoàn toàn được làm sáng tỏ.

(A) Tế bào T sau khi được hoạt hóa bởi phức hợp pMHC:TCR và B7:CD28 (hoạt hóa tế bào T), thì biểu hiện CTLA-4. CTLA-4 cạnh tranh B7 với CD28 và ức chế tế bào T (ức chế tế bào T). Kháng thể CTLA-4 (anti-CTLA4) tương tác với CTLA-4, do đó giải phóng ức chế miễn dịch (giải phóng ức chế).
(B) PD-1 được biểu hiện ở tế bào T hoạt hóa (hoạt hóa tế bào T). PD-L1 của tế bào ung thư (tumor cell) tương tác với PD-1 làm cho tế bào T bị bất hoạt (ức chế tế bào T). Kháng thể PD-1 (anti-PD-1) hoặc PD-L1 (anti-PD-L1) lần lượt tương tác với PD-1 hoặc PD-L1, do đó tái hoạt hóa tế bào T “bất hoạt” (giải phóng ức chế).
4. Chỉ định cho liệu pháp ức chế kiểm soát miễn dịch
Liệu pháp ức chế CTLA-4 và PD-1/PD-L1 vượt trội những liệu pháp điều trị truyền thống trong việc cải thiện chất lượng và thời lượng sống của nhiều bệnh nhân ung thư, nhưng số lượng bệnh nhân có đáp ứng điều trị vẫn ở dưới mức 50% đối với các liệu pháp đơn trong khi các liệu pháp kết hợp lại tốn kém. Do đó việc lựa chọn bệnh nhân có khả năng đáp ứng với liệu pháp này sẽ góp phần quan trọng trong việc phát huy tối đa lợi ích của liệu pháp này. Hiện tại, mức độ biểu hiện của PD-L1 và trạng thái MSI (microstalite instability) trong khối u là chất chỉ thị được cấp phép để lựa chọn bệnh nhân phù hợp cho liệu pháp ức chế PD-1/PD-L1. Các thử nghiệm lâm sàng để lựa chọn các chất chỉ thị có khả năng dự đoán đáp ứng điều trị của liệu pháp ức chế chốt kiểm miễn dịch bao gồm mức độ đột biến của khối u (tumor burden mutation) và bộ dấu chuẩn gen (gene signatures) đang được triển khai.
Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.