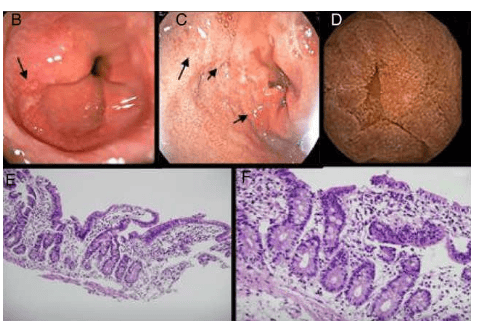
Sự phân hủy niêm mạc đại tràng trong bệnh amip đường ruột có liên quan đến nhiều loại phân tử do E. histolytica sản xuất : chất kết dính, lỗ amip và protease.
Bài viết được viết bởi ThS.BS Mai Viễn Phương - Bác sĩ nội soi tiêu hóa, Khoa Khám bệnh & Nội khoa - Bệnh viện Đa khoa Quốc tế Vinmec Central Park.
Một lectin bám dính đa chức năng cho phép ký sinh trùng bám vào lớp chất nhầy đại tràng, do đó tránh bị đào thải qua dòng ruột. Lectin cũng tham gia vào quá trình truyền tín hiệu phân hủy tế bào và ngăn chặn sự lắng đọng của phức hợp tấn công màng có hại của bổ thể, và nó có thể tham gia vào quá trình neo giữ amip vào proteoglycan trong quá trình xâm nhập. Protease có thể được sử dụng để phân hủy ma trận ngoại bào trong quá trình xâm nhập và hỗ trợ quá trình phân hủy các tế bào đích. Quan sát cuối cùng về tổn thương xâm lấn sớm với loét nông là thâm nhiễm nhẹ đến trung bình của lớp niêm mạc. Ở giai đoạn này, thâm nhiễm tế bào xung quanh amip xâm lấn dẫn đến sự phân hủy nhanh chóng các tế bào viêm và hoại tử mô. Những quan sát này đã được xác nhận trong các mô hình động vật gặm nhấm mắc bệnh amip đường ruột.
Sự thâm nhiễm bạch cầu trung tính vào lớp niêm mạc
Bạch cầu trung tính, chiếm hơn 90% bạch cầu hạt lưu thông, phản ứng với nhiều loại cytokine và các yếu tố hòa tan trong quá trình phản ứng viêm. C5a, sản phẩm phân cắt của thành phần bổ sung C5, là một trong những phân tử hoạt hóa và hướng động mạnh nhất đối với thực bào. Tuy nhiên, trong các tổn thương đường ruột do amip, sự tham gia của C5a vào quá trình thâm nhiễm bạch cầu trung tính của lớp niêm mạc vẫn chưa chắc chắn, vì các động vật nguyên sinh E. histolytica giải phóng một loại protease cysteine trung tính có tác dụng phân hủy phân tử này.
Trong những năm gần đây, người ta đã chứng minh được rằng tình trạng viêm ruột không chỉ là kết quả của phản ứng của hệ thống miễn dịch đối với tổn thương đường ruột mà còn là kết quả của sự tương tác phức tạp giữa các tương tác tế bào miễn dịch và không miễn dịch liên quan đến các tế bào biểu mô, trung mô, nội mô và thần kinh, cũng như các thành phần của ECM.
Các nghiên cứu về miễn dịch niêm mạc đã cung cấp bằng chứng ngày càng tăng rằng các tế bào biểu mô ruột, ví dụ, liên tục biểu hiện hoặc có thể được kích thích để biểu hiện một số cytokine hoạt động miễn dịch và các yếu tố hòa tan, bao gồm interleukin-8 (IL-8), protein hấp dẫn đơn bào 1, yếu tố kích thích khuẩn lạc bạch cầu hạt-đại thực bào và yếu tố hoại tử khối u alpha (TNF-α). Do đó, ngoài các chức năng hấp thụ và tiết cơ bản của chúng, các tế bào biểu mô ruột là thành phần không thể thiếu và thiết yếu của hệ thống miễn dịch bẩm sinh và mắc phải của vật chủ.
Bạch cầu trung tính được tuyển dụng và hoạt hóa nhanh chóng để đáp ứng với cytokine tiền viêm IL-8. Trong các dòng tế bào biểu mô ruột kết của người, các thể tư dưỡng của E. histolytica làm tăng tiết IL-8 và TNF-α. Ít nhất ba cơ chế có thể đã được mô tả để điều hòa tăng IL-8. Một số dòng tế bào biểu mô ruột kết làm tăng tiết IL-8 để đáp ứng với IL-1α đã hình thành sẵn được giải phóng từ các tế bào bị E. histolytica phân hủy.
Trong các dòng tế bào khác thiếu IL-1α đã hình thành sẵn, việc tăng sản xuất IL-8 dường như được trung gian bởi sự bám dính của các thể tư dưỡng thông qua lectin Gal-GalNAc thông qua một cơ chế liên quan, ít nhất là một phần, đến sự gia tăng [Ca2 + ] i. Trong cơ chế thứ ba, các sản phẩm tiết ra của E. histolytica có thể gây ra sự tiết IL-8 khi không có sự tiếp xúc của thể tư dưỡng. Cho dù bất kỳ cơ chế nào trong số này diễn ra trong quá trình nhiễm trùng đường ruột tự nhiên vẫn chưa được xác định, nhưng sự hỗ trợ thêm cho tầm quan trọng của các tế bào biểu mô ruột như là nhà sản xuất các cytokine gây viêm đến từ các nghiên cứu sử dụng mô hình ghép dị loại ruột chuột-người suy giảm miễn dịch kết hợp nghiêm trọng (SCID).
Cuối cùng, một hoạt động hấp dẫn hóa học đối với bạch cầu trung tính đã được tìm thấy trong E. histolytica. Mặc dù phân tử chịu trách nhiệm cho hoạt động này vẫn chưa được tinh chế, nhưng phương pháp xử lý bằng enzym cho thấy rằng nó tương ứng với một peptit liên kết màng.
Vai trò của bạch cầu trung tính
Sự thâm nhiễm tế bào xung quanh amip xâm lấn dẫn đến sự phân hủy nhanh chóng các tế bào viêm tiếp theo là hoại tử mô. Lý do khiến bạch cầu trung tính không thể tiêu diệt E. histolytica vẫn chưa được biết rõ. Trong các bệnh nhiễm trùng ký sinh trùng khác, bạch cầu trung tính tiêu diệt vi sinh vật xâm lược theo cả cơ chế phụ thuộc và không phụ thuộc O 2 ; chúng tạo ra một vụ bùng nổ oxy hóa mạnh mẽ và các hạt tiết của chúng chứa các phân tử có độc tính cao. E. histolytica có thể tránh được vụ bùng nổ oxy hóa thông qua một superoxide dismutase chứa sắt có thể được các anion superoxide tạo ra để tạo ra H 2 O 2.
Ngoài ra, một NADPH: oxidoreductase lưỡng chức chứa hoạt động khử disulfide phụ thuộc NADPH và NADPH oxidase tạo thành H 2 O 2 có thể hỗ trợ giải độc các hydroperoxide được tạo ra trong quá trình stress oxy hóa. Mặc dù amip không chứa catalase, một loại protein 29-kDa giàu cysteine trong amip đã được chứng minh là có thể loại bỏ H 2 O 2 . Tuy nhiên, không có bằng chứng nào về cách E. histolytica có thể thoát khỏi tác động của các phân tử độc tế bào do bạch cầu trung tính giải phóng. Ký sinh trùng này phải sở hữu các cơ chế bảo vệ chống lại các peptidases ly giải của chính nó vẫn chưa được khám phá, nhưng liệu nó có sử dụng chúng để tránh bị các phân tử độc tế bào bên ngoài tấn công hay không vẫn chưa được biết.
Ngoài ra, có thể suy đoán rằng các bạch cầu trung tính có trong các tổn thương do E. histolytica ở người không được kích hoạt đúng cách. Như đã nêu ở trên, con người là vật chủ tự nhiên duy nhất của E. histolytica.
Thật không may, cho đến nay vẫn chưa có mô hình thực nghiệm nào được phát triển để tái tạo các tổn thương do amip xâm lấn đường ruột được thấy trong bệnh amip đường ruột ở người. Mặc dù kết quả có khả năng tái tạo cao với mô hình tốt nhất hiện có, chuột nhảy, nhưng chúng chỉ có thể bắt chước các giai đoạn đầu của bệnh nhiễm trùng nhưng sẽ khỏi trong vòng 96 giờ. Điều này được giải thích là khả năng kháng bẩm sinh đối với E. histolytica.
Các nghiên cứu gần đây sử dụng mô hình gây áp xe gan do amip đã bắt đầu khám phá cơ sở tế bào của khả năng kháng bẩm sinh này ở chuột. Sau khi tiêm chủng nội gan các thể dinh dưỡng, chuột bị giảm bạch cầu trung tính phát triển các tổn thương gan lớn hơn chuột bình thường, cho thấy vai trò của bạch cầu trung tính, mặc dù chỉ một phần, trong cơ chế kháng thuốc ở những loài gặm nhấm này. Ngoài ra, trong mô hình gan chuột đồng dễ bị nhiễm bệnh, trái ngược với những gì xảy ra với E. histolytica, bạch cầu trung tính loại bỏ hiệu quả E. dispar trong vòng 24 giờ. So sánh các phản ứng do hai loài amip gây ra trong nhiễm trùng gan và ruột thực nghiệm có thể làm sáng tỏ một số hành vi gây bệnh khác biệt đáng kinh ngạc của chúng.
Bạch cầu trung tính không chỉ không chống lại được E. histolytica mà trên thực tế còn có thể góp phần gây tổn thương mô vật chủ thông qua việc phá hủy và giải phóng các hạt độc tế bào. Trong ống nghiệm, bạch cầu trung tính ở người thậm chí còn bị tiêu diệt bởi các chủng E. histolytica có độc lực thấp theo tỷ lệ bạch cầu trung tính so với amip là 400:1, mặc dù nhiều loại ký sinh trùng này không chống lại được trong quá trình này. Tuy nhiên, các chủng có độc lực cao lại chiến thắng sau khi ủ với 3.000 bạch cầu trung tính trên một amip.
Ngoài sự đóng góp của bạch cầu trung tính, amip còn đóng vai trò trực tiếp trong hoại tử mô. Bằng chứng về điều này chỉ có từ mô hình gây áp xe gan do amip, trong đó ký sinh trùng có thể gây tổn thương gan khi không có phản ứng viêm ở chuột bị giảm bạch cầu trung tính. Trong cùng báo cáo, hình ảnh cho thấy quá trình apoptosis của tế bào gan gần với thâm nhiễm viêm hoặc ở các vùng nhu mô gan xa amip hoặc tế bào viêm được hiển thị.
Tài liệu tham khảo
1. Adler P, Wood S J, Lee Y C, Lee R T, Petri W A, Jr, Schnaar R L. High affinity binding of the Entamoeba histolytica lectin to polyvalent N-acetylgalactosaminides. J Biol Chem. 1995;270:5164–5171.
2. Aguirre A, Warhurst D C, Guhl F, Frame I A. Polymerase chain reaction-solution hybridization enzyme-linked immunoassay (PCR-SHELA) for the differential diagnosis of pathogenic and non-pathogenic Entamoeba histolytica. Trans R Soc Trop Med Hyg. 1995;89:187–188.