Bài viết được viết bởi TS. Ngô Anh Tiến – Ngân hàng mô Vinmec
Hiện nay, khi nhắc tới liệu pháp tế bào để điều trị các căn bệnh nan y thì không thể không nhắc tới tế bào gốc trung mô (MSCs) và các ứng dụng quan trọng của nó. Tác dụng của tế bào gốc trung mô trong y học tái tạo không chỉ là đóng góp sinh khối mới thông qua khả năng biệt hóa thành các loại mô khác nhau mà còn có khả năng điều chỉnh mô nội sinh thông qua tín hiệu tế bào và các con đường khác. Do đó MSCs đang trở thành một điểm nhấn của y học tái tạo và đang được đánh giá trong một loạt các chỉ định lâm sàng.
Chẳng hạn, MSCs hiện đang được thử nghiệm như một phương pháp điều trị cho nhiều loại bệnh trung gian miễn dịch (immune mediated diseases) khác nhau. Danh mục này ngày một mở rộng khi các nhà khoa học tìm ra rằng có nhiều căn bệnh có rối loạn điều hòa miễn dịch hoặc hiện tượng viêm mãn tính hơn so với những nhận biết và dự kiến trong quá khứ. Ngoài ra, MSCs còn được dùng như một phương pháp điều trị cho bệnh ghép vật chủ (Graft vesus Host Disease), ung thư và một số bệnh thoái hóa thần kinh như bệnh đa xơ cứng hay bệnh Alzheimer.
Gần nhất, những kết quả nghiên cứu công bố vào tháng 1/2021 cho thấy, MSCs có tác dụng đáng kinh ngạc và tạo ra kết quả đột phá trong điều trị các ca nhiễm COVID-19 thể nặng. Việc quyết định ứng dụng MSCs vào liệu pháp điều trị dựa trên cơ sở các nhà khoa học cho rằng các triệu chứng nghiêm trọng nhất của bệnh nhân COVID-19 như Hội chứng suy hô hấp cấp (Acute Respiratory Distress Syndrome ARDS) hay suy tạng là do sự rối loạn điều hòa miễn dịch đã dẫn đến các cơn bão cytokine. Khi truyền vào cơ thể người bệnh, MSCs làm giảm tổn thương miễn dịch trung gian ở phổi bằng cách điều chỉnh phản ứng viêm và sửa chữa các kích thích.
Không giống như cách chống viêm rộng truyền thống bằng cách sử dụng dược phẩm như corticosteroid, MSCs tương tác với các mô một cách phối hợp và chính xác hơn. Nhờ đó, chúng tái cân bằng các phản ứng miễn dịch bằng cách tăng lượng cytokines chống viêm (anti-inflammatory cytokines) và giảm cytokine tiền viêm (pro-inflammatory cytokines, loại cytokines khiến bệnh trạng nặng hơn).
Số liệu báo cáo cho thấy, tỷ lệ sống sót của bệnh nhân thể nặng phải sử dụng máy thở có sử dụng liệu pháp MSCs lên tới 75%, trong khi tỷ lệ sống sót ở nhóm đối chứng không sử dụng liệu pháp MSCs là 15% (theo báo cáo của Mesoblast).
>>> Tế bào gốc trung mô từ dây rốn và tác dụng đột phá trong nghiên cứu điều trị COVID-19
1. MSCs được thu thập thế nào?
Tiềm năng ứng dụng to lớn của MSCs trong y học tái tạo điều trị các căn bệnh hiểm nghèo đặt ra yêu cầu đối với việc thu thập và sản xuất trên quy mô lớn loại tế bào gốc đa năng này. Tính tới hiện tại, nguồn thu MSCs được biết đến có một số loại như sau:
- Tủy xương (Born Marrow – BM). MSCs có thể được thu thập trực tiếp từ tủy xương của bệnh nhân hoặc người hiến tặng. Tuy nhiên, biện pháp này gây đau đớn, có khả năng biến chứng và chỉ tạo ra một số lượng MSCs hạn chế, nhiều trong số đó có thể không có khả năng tự tái tạo. Vì MSCs chỉ chiếm khoảng 0,001 đến 0,01 phần trăm tổng số tế bào nên mỗi mẫu tủy xương chỉ có thể cung cấp 60 đến 600 tế bào trên mỗi mililit. Do đó, để tạo ra đủ số lượng tế bào cho các ứng dụng lâm sàng ở người, cần một lượng lớn các mẫu tủy xương và nuôi cấy ex vivo rộng rãi. Tất cả những yếu tố này làm cho việc sử dụng MSCs có nguồn gốc từ tủy xương (BM-MSCs) để sản xuất MSCs trên quy mô lớn có phần thiếu thực tế (Mastrolia et al., 2019).
- Mô mỡ (Adipose Tissue Derived Mesenchymal Stem Cells AT-MSCs). Mô mỡ đang được đánh giá là giải pháp thay thế có triển vọng cao cho BM – MSCs do dễ thu thập (sử dụng các phương pháp ít xâm lấn hơn, chẳng hạn như hút mỡ), năng suất cao hơn (lượng MSCs nhiều hơn khoảng 500 lần so với tủy xương) và có khả năng tăng sinh, dẫn đến thời gian mở rộng nguồn tế bào ngắn hơn.
- Mô chu sinh, mô răng, máu nội mạc tử cung. Trong đó, mô chu sinh còn được biết đến với tên gọi thông dụng hơn là mô dây rốn đang nổi lên là một nguồn MSCs tuyệt vời với những ưu điểm vượt trội.
2. Mô dây rốn và Tế bào gốc sơ sinh
Tế bào gốc sơ sinh là tế bào gốc thu thập từ mô dây rốn và máu cuống rốn. Mô dây rốn chứa tế bào gốc trung mô MSCs và máu cuống rốn chứa cả tế bào gốc tạo máu (những tế bào có khả năng sản xuất tế bào máu) và MSCs. Cả máu cuống rốn và mô dây rốn đều có thể được thu thập thông qua các quy trình đơn giản lại tuyệt đối an toàn cho cả sản phụ và trẻ sơ sinh trong quá trình sinh nở, lưu trữ đông lạnh và sau đó được mở rộng để tạo ra các dòng tế bào gốc đa năng cảm ứng (iPSCs) hoặc một lượng đáng kể MSCs để sử dụng trong các liệu pháp tế bào.
>>> Máu cuống rốn được lấy vào thời điểm nào sau khi sinh?
Tế bào gốc trong máu cuống rốn được nhắc tới nhiều từ những năm 70 của thế kỷ trước và tới năm 1983, nhà khoa học Kenichi Koike đã chứng minh rằng việc lưu trữ đông lạnh các tế bào này không làm ảnh hưởng tới các hoạt tính và chức năng của chúng. Ca cấy ghép máu cuống rốn đầu tiên diễn ra vào năm 1988 tại Pháp đã mở ra kỷ nguyên mới trong điều trị các căn bệnh hiểm nghèo. Ngay sau đó, vào năm 1990 tại Anh, 1994 tại Nhật Bản và Hà Lan, năm 1996 tại Tây Ban Nha... máu cuống rốn đã được phép đưa vào điều trị bệnh. Cùng với đó là sự ra đời của các ngân hàng máu cuống rốn. Tuy nhiên một cách tổng thể, dù tính tới thời điểm hiện tại, trên thế giới có trên 350 ngân hàng, thì tỷ lệ lưu trữ vẫn còn thấp. Tại Mỹ, mỗi năm, có khoảng 3,5 triệu ca sinh nhưng chỉ có 5% dân số lựa chọn dự trữ các tế bào gốc sơ sinh. Máu và mô dây rốn là một nguồn tài nguyên sinh học quý giá, dễ thu thập, có thể có những công dụng quan trọng cho việc điều trị tự thân cho chính người hiến sau này hoặc các ứng dụng rộng rãi hơn trong y học tái tạo nhưng vẫn chưa được khai thác một cách hiệu quả.
3. Ưu điểm vượt trội của tế bào gốc sơ sinh
Một trong những ưu điểm chính của tế bào gốc sơ sinh là sự dễ dàng thu thập và bảo quản. Ngay khi đứa trẻ được sinh ra, kỹ thuật viên sẽ tiến hành thu thập máu cuống rốn thông qua tĩnh mạch dây rốn và cho vào các túi chuyên dụng có chất chống đông để bảo quản. Đối với dây rốn, việc thu thập còn đơn giản hơn nhiều. Kỹ thuật viên chỉ cần cắt lấy phần dây rốn thích hợp, xử lý và đặt vào dụng cụ bảo quản chuyên dụng.
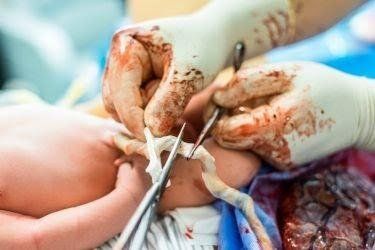
Sau khi thu thập, các mẫu được đông lạnh nhanh chóng để đảm bảo hầu hết các đặc tính và khả năng sống sót của tế bào gốc sơ sinh. Do đó, khi rã đông chúng vẫn có khả năng phát triển khỏe mạnh, tăng sinh tốt. Tế bào gốc trung mô được tạo ra từ mô dây rốn đáp ứng tất cả các đặc điểm tiêu chuẩn công nghiệp và đặc điểm lâm sàng của MSCs.
Ngoài ra, chúng có khả năng mở rộng đáng kinh ngạc, thường cao hơn và vượt xa so với BM-MSCs có nguồn gốc từ người lớn. Điều này được các nhà khoa học xác định là do những lợi thế đặc biệt của tế bào gốc sơ sinh, liên quan trực tiếp tới độ tuổi hiến tặng tế bào. Một cách thường thức, sự thay đổi từ lô này sang lô khác là hạn chế của quá trình sản xuất, đặc biệt là khi làm việc với tế bào sống. Tế bào gốc lấy từ máu cuống rốn và mô dây rốn ít thay đổi hơn, đơn giản vì trẻ sơ sinh chưa tiếp xúc với nhiều yếu tố gây căng thẳng, như đột biến hoặc mầm bệnh. Kết quả là, khi các tế bào này được mở rộng thành các dòng tế bào, các mô nói chung đồng nhất hơn. Người hiến tặng càng lớn tuổi, càng có nhiều biến thể trong các tế bào mà họ hiến tặng. Điều này làm tăng khả năng chúng có các đặc điểm không mong muốn. Vì vậy việc thu thập các tế bào trẻ hơn với thời gian sống của vật chủ ngắn hơn là một lợi thế.
4. Các ứng dụng trong tương lai của các liệu pháp MSC
Tế bào gốc trung mô và ứng dụng của nó trong các liệu pháp tế bào ngày càng được tập trung đầu tư nghiên cứu và thử nghiệm lâm sàng. Trước đây MSCs chỉ được sử dụng để tái tạo một số mô nhất định trong phòng thí nghiệm còn bây giờ, sự phát triển của y học tái tạo đã cho phép sự ra đời của một danh mục mở rộng các liệu pháp điều trị được cá nhân hóa bao gồm các liệu pháp miễn dịch, tế bào và gen. MSCs có vai trò quyết định tương lai của y học chính xác và cá nhân hóa.
Trong tương lai gần, chúng ta có thể có một loạt các biện pháp điều trị mà trước đây chưa từng mơ tới. Đơn cử là việc ứng dụng tế bào gốc trung mô MSCs trong việc điều trị cho các bệnh nhân COVID-19 thể nặng như đề cập đến ở phần trên. Thành công đó cũng truyền cảm hứng cho các bác sĩ và nhà khoa học tiếp tục tìm hiểu thêm về các cơ chế nền tảng của rối loạn điều hòa miễn dịch cũng như các nghiên cứu bổ sung khác. Bởi ở cấp độ tế bào, các tương tác không đơn giản như những sơ đồ về điều hòa miễn dịch hoặc hormone nơi điểm A đến điểm B đến điểm C. Sử dụng MSCs chống lại các căn bệnh không đồng nhất vừa quan trọng đối với bệnh nhân vừa là điều thú vị đối với các nhà nghiên cứu, bởi vì các nhà nghiên cứu có thể hiểu rõ hơn về những gì đang thực sự diễn ra trong môi trường viêm dưới tế bào trong từng trường hợp riêng lẻ.
5. Cách mạng MSCs với tế bào gốc sơ sinh
Vậy, liệu các tế bào gốc sơ sinh có thể tạo ra một cuộc cách mạng trong các liệu pháp MSCs? Câu trả lời là có, bởi những ưu điểm vượt trội của tế bào gốc sơ sinh - bao gồm sự phong phú, dễ thu thập, khả năng mở rộng và tính đồng nhất tương đối của các sản phẩm mà chúng có thể sản xuất - chắc chắn khiến chúng trở thành một lựa chọn hấp dẫn hơn so với tế bào gốc tủy xương BM-MSCs để sản xuất trên quy mô lớn tế bào cho các liệu pháp nghiên cứu và điều trị sử dụng tế bào gốc trung mô.
Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.
Bài viết tham khảo nguồn:
- https://www-europeanpharmaceuticalreview-com.cdn.ampproject.org/c/s/www.europeanpharmaceuticalreview.com/article/135673/could-newborn-stem-cells-revolutionise-cell-therapies/amp/
- Mastrolia, I., Foppiani, E.M., Murgia, A., et al. Challenges in Clinical Development of Mesenchymal Stromal/Stem Cells: Concise Review. 2019. STEM CELLS Translational Medicine, 8: 1135-1148.
- Wagner, J. E and Gluckman, E. Umbilical Cord Blood Transplantation: The First 20 Years. 2010. Seminars in Hematology, 47: 3-12.