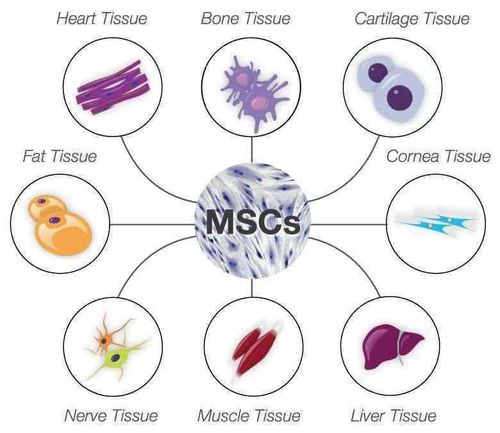
Tế bào gốc trung mô là một loại tế bào gốc có những đặc tính sinh học đặc biệt, bao gồm khả năng phân chia và tăng sinh khi được nuôi cấy trong môi trường nhân tạo (gọi là tế bào gốc ngoại sinh). Điểm nổi bật của loại tế bào này là khả năng biến đổi thành các loại tế bào khác như tế bào xương, tế bào sụn, tế bào mỡ và tế bào thần kinh.
Bài viết này được viết dưới sự hướng dẫn chuyên môn của TS.BS Hoàng Minh Đức - Trưởng phòng Nghiên cứu và phát triển công nghệ tế bào gốc - Viện nghiên cứu Tế bào gốc và Công nghệ gen Vinmec.
1. Tế bào gốc trung mô là gì?
Tế bào gốc trung mô là những tế bào gốc đa năng trưởng thành. Khi được nuôi cấy ở ngoài cơ thể (tế bào gốc ngoại sinh), tế bào này sẽ có thể biệt hóa thành các tế bào chức năng như sụn, mỡ, xương, thần kinh, gan, thận,...
Bên cạnh đó, tế bào gốc trung mô cũng đóng vai trò quan trọng trong hệ thống miễn dịch, cả miễn dịch bẩm sinh và miễn dịch thích ứng. Tế bào này điều hòa hệ miễn dịch chủ yếu bằng cách tương tác trực tiếp với các tế bào miễn dịch khác và tiết ra các cytokine để ảnh hưởng đến các tế bào xung quanh. Đặc biệt, tế bào này có mức biểu hiện thấp của MHC lớp I và không biểu hiện HLA-DR, giúp loại tế bào này tránh được phản ứng thải ghép.
Với những đặc tính đặc biệt này, việc ứng dụng tế bào gốc trung mô trong lĩnh vực điều trị y tế, đặc biệt là trong y học tái tạo, đang ngày càng được mở rộng và nhận được nhiều sự chú ý.
2. Tổng quan tế bào gốc trung mô được tìm thấy ở đâu và sơ lược ứng dụng
Trong cơ thể con người, tế bào gốc trung mô có mặt ở nhiều cơ quan khác nhau, đặc biệt phong phú ở tủy xương, mô mỡ và dây rốn. Trong lĩnh vực ứng dụng y tế, ba loại tế bào gốc trung mô chính được sử dụng bao gồm: tế bào gốc từ tủy xương (BM-MSC), tế bào gốc từ mô mỡ (AD-MSC), và tế bào gốc từ dây rốn (UC-MSCs). Những loại tế bào này rất quan trọng trong điều trị các bệnh liên quan đến khớp gối, bại não, bệnh phổi tắc nghẽn mạn tính (COPD), loạn sản phế quản phổi, tiểu đường, cải thiện trẻ hoá da mặt và nhiều bệnh lý khác.
Các loại tế bào này đã chứng minh được độ an toàn cao sau khi cấy ghép và hiệu quả trong điều trị các bệnh về hệ thần kinh, hô hấp nhờ vào khả năng điều hoà miễn dịch. Loại tế bào này có thể giúp giảm viêm, hạn chế kích ứng miễn dịch tại các vùng bị viêm và ức chế hoạt động của các tế bào miễn dịch. Ngoài ra, tế bào này còn tiết ra các yếu tố kích thích tăng trưởng và các vi thể ngoại bào, hỗ trợ quá trình tái tạo các tế bào thần kinh và kích thích sự phát triển của các tế bào gốc nội sinh.

Vì những lý do này, việc bảo quản các loại tế bào gốc như BM-MSC, AD-MSC và UC-MSCs để sử dụng trong tương lai khi cần thiết là một biện pháp hợp lý và thiết thực đối với khách hàng, đảm bảo nguồn tế bào dồi dào cho các mục đích điều trị.
3. Tế bào gốc trung mô từ tủy xương
Kể từ những năm 1950, tủy xương được biết đến trong giới y khoa là nguồn phong phú các tế bào gốc tạo máu và các tế bào hỗ trợ khác, tham gia vào quá trình sản xuất các thành phần máu. Vào những năm 1960, hai nhà khoa học Ernest A. McCulloch và James E. Till đã tiến hành các thí nghiệm trên dung dịch tủy xương và phát hiện ra khả năng tạo cụm tế bào từ các tế bào có trong tủy xương.
Các công trình nghiên cứu tiếp theo của Friedenstein trong thập niên 70 đã chứng minh được khả năng phân chia và tăng sinh của các tế bào gốc trung mô từ tủy xương khi được nuôi cấy ngoài cơ thể (ex vivo). Những thí nghiệm này đã mở ra khả năng của các tế bào này trong việc biệt hóa thành các loại tế bào khác như xương, sụn và mỡ, qua đó đưa đến sự ra đời của khái niệm tế bào gốc trung mô, hay còn gọi là Mesenchymal Stem Cells (MSCs).
Trong tủy xương, tỷ lệ của tế bào gốc trung mô chỉ chiếm từ 0.001% đến 0.01% tổng số tế bào đơn nhân. Tuy nhiên, với điều kiện nuôi cấy thích hợp, dù số lượng nhỏ, các tế bào này vẫn có thể phát triển mạnh mẽ và biệt hóa thành nhiều loại tế bào khác nhau, thể hiện tiềm năng lớn trong lĩnh vực y học tái tạo.

Tế bào gốc trung mô từ tủy xương được biết đến là loại tế bào gốc đa năng, chủ yếu biệt hóa thành các dòng tế bào của lớp trung mô như tế bào xương, sụn và mỡ. Tuy nhiên, các nghiên cứu cũng chỉ ra rằng tế bào này có khả năng biệt hóa thành tế bào gan, tim, thần kinh, mặc dù quá trình này rất phức tạp và tỷ lệ thành công không cao.
Để phân lập tế bào gốc trung mô từ tủy xương một cách hiệu quả, việc sử dụng kỹ thuật ly tâm tỉ trọng Ficoll để tách các tế bào đơn nhân trong tủy xương là phương pháp được ưa chuộng vì tính đơn giản, kinh tế và nhanh chóng. Nguyên lý cơ bản của kỹ thuật này nằm ở quá trình phân tách các loại tế bào khác nhau bên trong tủy xương dựa vào tỉ trọng của chúng khi ly tâm với Ficoll.
Sau khi ly tâm, hồng cầu, tế bào bạch cầu trung tính và các cặn xương sẽ lắng xuống dưới cùng, trong khi lớp tế bào đơn nhân sẽ tập trung tại lớp Buffy coat - giữa lớp Ficoll và huyết tương.
Trong giai đoạn đầu của quá trình nuôi cấy (Passage 0 – P0), tế bào gốc trung mô từ tủy xương có hình dạng giống nguyên bào sợi với kích thước nhỏ, hai đầu tế bào phân cực kéo dài và có khả năng tăng sinh và nhân đôi ở tốc độ chậm.
Qua các lần nuôi cấy, hình thái của tế bào trở nên đồng nhất và khả năng phân chia tăng nhanh hơn. Khi đã ổn định, các tế bào này có thể được cấy chuyển từ 10 đến 20 lần, tuỳ thuộc vào bản chất của tế bào liên quan đến các yếu tố như độ tuổi, tình trạng sức khỏe của người hiến.
4. Tế bào gốc trung mô từ mô mỡ
Hiểu biết về tế bào gốc trung mô từ mô mỡ phần lớn dựa trên các nghiên cứu sinh học cơ bản liên quan đến chức năng và cấu trúc của mô mỡ trong cơ thể con người.
Mô mỡ, vốn là một loại mô nền, thường nằm dưới da hoặc bao quanh các cơ quan nội tạng, đảm nhận các chức năng chính như bảo vệ, cách nhiệt và lưu trữ năng lượng. Có hai loại mô mỡ chính là mô mỡ nâu và mô mỡ trắng. Mô mỡ nâu, đặc biệt phổ biến ở trẻ sơ sinh, có chức năng giữ ấm cho cơ thể nhờ vào số lượng lớn ti thể có khả năng trao đổi chất cao. Ở người lớn, mô mỡ trắng chiếm ưu thế và thường xuyên xuất hiện dưới da.

Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.