This is an automatically translated article.
Myelodysplastic syndrome (MDS) is a group of disorders characterized by a decrease in peripheral blood cells, disorders of hematopoietic progenitors, increased or decreased bone marrow cells, with a high risk of transforming into disease. acute myeloid leukemia (AML). Read on to learn more about myelodysplastic syndromes (MDS).
1. What is myelodysplastic syndrome (MDS)?
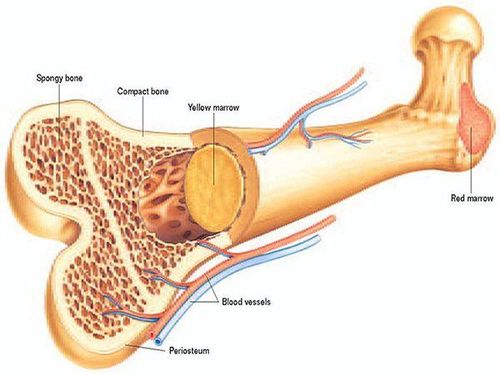
Myelodysplastic syndromes (MDS) refer to a heterogeneous group of closely related clonal hematopoietic disorders commonly seen in the elderly population. All are characterized by one or more peripheral blood cells. The bone marrow is usually hypercellular, but rarely a cytopenia may be seen mimicking aplastic anemia. Bone marrow cells have abnormal morphology and maturation (muscle dystrophy), resulting in inefficient blood cell production and decreased bone marrow cells.
MDS affects hematopoiesis at the stem cell level, as indicated by cytogenetic abnormalities, molecular mutations, and morphological and physiological abnormalities during maturation and differentiation of one or more hematopoietic cell lines.
MDS may involve one, two, or all three of the myeloid hematopoietic cell lines — red blood cells, granulocytes, megakaryocytic leukocytes — depending on the subtype and stage of the disease. The heterogeneity of MDS reflects the fact that its process involves a wide range of cytogenetic events. In a small subset of patients, the acquisition of additional genetic abnormalities resulted in the transformation of MDS into acute myeloid leukemia (AML). So, although MDS is clonal, it is considered a premalignant condition.
Patients with MDS may present with clinical manifestations of anemia, peripheral blood cell and/or neutropenia, and bone marrow cytopenia. Studies in patients likely to have MDS include complete blood count with differential studies, peripheral blood smears, and bone marrow.
2. Features of myelodysplastic syndrome (MDS)
2.1 Sinh lý bệnh MDS phát triển khi đột biến dòng chiếm ưu thế trong tủy xương, ngăn chặn các tế bào gốc khỏe mạnh. Đột biến dòng vô tính có thể là do khuynh hướng di truyền hoặc do tổn thương tế bào gốc tạo máu do tiếp xúc với bất kỳ chất nào sau đây:
Hóa trị độc tế bào Sự bức xạ Nhiễm virus Hóa chất gây độc cho gen (ví dụ: benzen) MDS có thể được phân loại là nguyên phát (de novo) hoặc thứ phát sau điều trị tích cực các bệnh ung thư khác, khi tiếp xúc với bức xạ, chất alkyl hóa hoặc chất ức chế topoisomerase II; nó cũng xảy ra ở những bệnh nhân được điều trị trước nặng bằng cấy ghép tủy xương tự thân .
Trong giai đoạn đầu của MDS, nguyên nhân chính của cytopenias là tăng quá trình chết theo chương trình (chết tế bào theo chương trình). Khi bệnh tiến triển và chuyển thành bệnh bạch cầu, đột biến gen tiếp tục xảy ra và sự gia tăng của các tế bào bạch cầu lấn át tủy khỏe mạnh.
2.2 Nguyên nhân gây hội chứng rối loạn sinh tủy (MDS) Về mặt di truyền tế bào, bệnh nhân MDS hoặc AML được chia thành ba nhóm:
Karyotype bình thường Bất thường nhiễm sắc thể cân bằng gây ra sự hình thành ung thư hợp nhất Karyotype phức tạp (thường> 3 bất thường) Bệnh nhân có karyotype phức tạp chiếm 30% các trường hợp MDS nguyên phát (chỉ 20% của AML de novo) và lên đến 50% các trường hợp MDS và AML liên quan đến điều trị. Những bệnh nhân này có tiên lượng và đáp ứng điều trị xấu hơn.
Bất thường chuyển vị cân bằng dẫn đến việc tạo ra các ung thư hợp nhất như Bcr-Abl trong bệnh bạch cầu nguyên bào tủy mãn tính (CML) và PML-Rar alpha trong bệnh bạch cầu nguyên bào nuôi cấp tính (APL). Quang sai lặp lại không cân bằng, phổ biến nhất là -5, 5q -, - 7, 7q-, +8, 11q-, 13q- và 20q-, gợi ý rằng các gen trong những vùng này có vai trò trong bệnh sinh của MDS hoặc rối loạn tăng sinh tủy (MPD ), dựa trên việc mất các gen ức chế khối u hoặc giảm năng suất đơn bội của các gen cần thiết cho quá trình tạo tủy bình thường.
Khoảng 80% bệnh nhân MDS không có phơi nhiễm hoặc nguyên nhân rõ ràng đối với MDS. Trong những trường hợp này, rối loạn được phân loại là MDS nguyên phát hoặc vô căn.
Tổ chức Y tế Thế giới (WHO) phân loại MDS thứ phát là MDS hoặc bệnh bạch cầu cấp tính phát triển nhiều năm sau khi đã biết có tiếp xúc với các nguồn gây tổn thương nhiễm sắc thể. Những bệnh nhân sống sót sau khi điều trị ung thư bằng các chất alkyl hóa, có hoặc không có xạ trị, có nguy cơ cao phát triển MDS hoặc bệnh bạch cầu cấp tính thứ phát từ 5-7 năm sau khi bị phơi nhiễm. Những loại thuốc này có liên quan đến tỷ lệ cao các bất thường nhiễm sắc thể trong tủy xương - đặc biệt là -5, del (5q), -7, del (q) và karyotype phức tạp.
MDS thứ phát sau khi điều trị bằng thuốc ức chế topoisomerase II như anthracycline hoặc etoposide xảy ra 1-3 năm sau khi tiếp xúc với các tác nhân này. Các bất thường về nhiễm sắc thể thường liên quan đến gen MLL
MDS cũng có thể phát triển sau khi tiếp xúc với một số hóa chất (ví dụ: benzen). Thuốc diệt côn trùng, thuốc diệt cỏ dại và thuốc diệt nấm cũng là những nguyên nhân có thể gây ra MDS và bệnh bạch cầu thứ phát. Nhiễm vi-rút cũng có liên quan. Ít bằng chứng ủng hộ khuynh hướng di truyền, nhưng tỷ lệ mắc bệnh gia đình đã được mô tả. Một số rối loạn tiểu cầu bẩm sinh với đột biến RUNX1 và GATA2 có thể dẫn đến MDS.
Mặc dù các trường hợp gia đình mắc hội chứng loạn sản tủy là rất hiếm, nhưng chúng rất có giá trị trong việc khảo sát cơ chế bệnh sinh phân tử của bệnh loạn sản tủy nói chung.
2.3 Triệu chứng lâm sàng của hội chứng rối loạn sinh tủy (MDS) Sự phát triển của hội chứng loạn sản tủy (MDS) có thể xảy ra trước một vài năm do thiếu máu đại mô không giải thích được mà không có bằng chứng về giảm tế bào máu ngoại vi và / hoặc giảm bạch cầu trung tính, giảm tế bào tủy xương (thiếu máu nguyên bào khổng lồ và giảm tiểu cầu nhẹ hoặc giảm bạch cầu). Các triệu chứng lâm sàng cần nhanh chóng điều trị MDS là do giảm tế bào máu ngoại vi, thường là do thiếu máu nhưng cũng do giảm tiểu cầu hoặc giảm bạch cầu.
Các triệu chứng lâm sàng do giảm tế bào máu ngoại vi: mệt mỏi, yếu, xanh (thứ phát do thiếu máu), tăng nhiễm trùng và sốt (thứ phát do giảm bạch cầu trung tính) và dễ chảy máu và bầm tím (thứ phát do giảm tiểu cầu). Chẩn đoán dựa vào công thức máu, tiêu bản máu ngoại vi, chọc hút dịch tủy xương. Điều trị bằng azacitidine hoặc decitabine có thể hữu ích; nếu bệnh bạch cầu cấp dòng tủy tăng cao, nó được điều trị theo các quy trình thông thường.
Các triệu chứng như mệt mỏi và khó chịu là kết quả của bệnh thiếu máu. Các dấu hiệu và triệu chứng của suy tim mãn tính có thể phát triển ở những bệnh nhân có các vấn đề về tim tiềm ẩn, tùy thuộc vào mức độ thiếu máu. Các đốm xuất huyết, đốm máu, chảy máu mũi và nướu là những biểu hiện phổ biến của số lượng tiểu cầu thấp. Nếu ban đầu bỏ qua những thay đổi loạn sản cơ bản, thì triệu chứng xuất hiện giảm tiểu cầu có thể bị nhầm với giảm tiểu cầu miễn dịch . Sốt, ho, khó tiểu, hoặc sốc có thể là biểu hiện của nhiễm trùng do vi khuẩn hoặc nấm nghiêm trọng ở bệnh nhân giảm bạch cầu. * Thăm khám
Khi khám sức khỏe, bệnh nhân mắc hội chứng loạn sản tủy (MDS) có thể có bằng chứng về giảm tiểu cầu, thiếu máu và / hoặc giảm bạch cầu. Giảm tiểu cầu thường biểu hiện như chấm xuất huyết hoặc đốm hồng cầu; chảy máu cam và chảy máu nướu răng gợi ý giảm tiểu cầu nghiêm trọng. Có thể xảy ra ho ra máu, tiểu ra máu và có máu trong phân.
Da và niêm mạc xanh xao hoặc bằng chứng mệt mỏi, nhịp tim nhanh hoặc suy tim sung huyết có thể là biểu hiện của thiếu máu nặng. Lá lách to có thể được tìm thấy ở những người bị bệnh bạch cầu myelomonocytic mãn tính (CMML), thường là dấu hiệu của hội chứng chồng chéo với MDS. CMML phải được phân biệt với bệnh bạch cầu nguyên bào tủy mãn tính (CML). Bệnh nhân có lá lách to có thể có các biến chứng liên quan đến vỡ tự phát và xuất tiết trong ổ bụng. Sự hiện diện của sốt và nhiễm trùng, chẳng hạn như viêm phổi và nhiễm trùng đường tiết niệu, có thể là do giảm bạch cầu trung tính liên quan đến MDS. * Chỉ số xét nghiệm
Những thay đổi đáng kể được tìm thấy trong công thức máu và hình thái của bệnh nhân MDS. Công thức máu ngoại vi có thể cho thấy giảm tiểu cầu đơn lẻ (thiếu máu, giảm tiểu cầu hoặc giảm bạch cầu) trong giai đoạn đầu hoặc giảm bạch cầu (thiếu 2 dòng tế bào) hoặc giảm bạch cầu (thiếu 3 dòng tế bào) trong giai đoạn sau. Tình trạng thiếu máu có nhiều mức độ từ nhẹ đến nặng. Nó thường là macrocytic (thể tích tế bào trung bình> 100 fL) với các tế bào hồng cầu (RBCs) có hình bầu dục (macro-ovalocytes). Nó thường là lưỡng hình (2 hoặc nhiều quần thể), với một quần thể vi hồng cầu bình thường hoặc ít nhiễm sắc thể (RARS) cùng tồn tại với các tế bào vĩ mô. Quan sát thấy hiện tượng ưa chảy máu có dấu chấm câu ở hồng cầu. Giảm bạch cầu trung tính có thể thay đổi từ nhẹ đến nặng. Các bất thường về hình thái thường được quan sát thấy trong các bạch cầu hạt. Chúng có thể bao gồm nhân hai lớp hoặc không phân mảnh (bất thường pseudo-Pelger-Huet) hoặc tăng phân mảnh trên nhân (6-7 thùy) tương tự như bệnh khổng lồ. Các bất thường về tạo hạt thay đổi từ trường hợp không có hạt đến phân bố bất thường bên trong tế bào chất (thể Dohle). Số lượng tiểu cầu giảm (hiếm khi tăng). Có các bất thường như tiểu cầu khổng lồ giảm sinh và các mảnh bạch cầu khổng lồ.
4. Diagnosis of myelodysplastic syndrome (MDS)
For studies in patients with suspected MDS (eg, due to leukocytosis), the following should be done:
History and physical examination Complete blood count (CBC) with difference Quantity reticulocytes Peripheral blood test Bone marrow aspiration with iron staining plus biopsies and cytogenetics using standard karyotyping; Consider serum Erythropoietin fibrosis (before red blood cell [RBC]) transfusion) Red blood cell folate, serum vitamin B12 Serum ferritin, iron, total iron-binding capacity (TIBC) Transfusion history Stimulating hormone thyroid (TSH) Lactate dehydrogenase (LDH) Genetic testing for somatic mutations (i.e., acquired mutations) in MDS-related genes is recommended Recommend additional molecular and genetic testing for with a genetic predisposition to hematologic malignancies in a small number of patients, especially in younger patients HIV testing if clinically indicated Consider evaluation for copper deficiency in patients with malabsorption GI, severe malnutrition, gastric bypass surgery, or patients on zinc supplementation Consider differentiation from congenital lateral cell anemia (CSA)
5. Treatment modalities for myelodysplastic syndromes (MDS)
Treatment based on modified International Prognostic Scoring System (IPSS-R) score, based on the patient's age and comorbidities, as well as the patient's individual expectations and goals . More aggressive and toxic forms of therapy, such as stem cell transplants and aggressive chemotherapy, are reserved for younger patients and are suitable for high-risk disease.
Cytotoxic chemotherapy is used in MDS patients with myeloproliferative neoplasms and those who have progressed to acute leukemia. The usual combination treatment is cytarabine plus anthracycline, which provides a limited response rate of 30-40%.
In the late stages, with leukemia transformation inevitable, cytotoxic chemotherapy and bone marrow transplantation may be necessary. All of these therapies are undergoing clinical trials to determine the overall benefit on quality of life and survival.
Cytotoxic chemotherapy is used in patients with MDS with myeloblast proliferation and who have progressed to acute leukemia. The usual combination therapy is the cytarabine-anthracycline combination, which yields a response rate of 30-40% (high rates of complications and morbidity in older patients).
Treatment with hypomethylating drugs (eg, azacytidine, decitabine) is considered standard therapy for both low-risk MDS cases without 5q-, as well as high- and intermediate-risk MDS. This approach is particularly useful in elderly patients, who have high morbidity and mortality with cytotoxic chemotherapy.
Patients with MDS should be under the care of a hematologist. Because most MDS treatments are not standard and are considered experimental, referral to a tertiary care center capable of a bone marrow transplant is often necessary.
Although treating symptoms improves quality of life in MDS, these measures are only temporary. More permanent measures are needed to stimulate the patient's bone marrow to produce mature blood cells.
* The ESMO recommendations are as follows:
Diagnosis is based on CBC, aspiration and marrow karyotype. Bone marrow biopsy is recommended at diagnosis. Molecular biology is useful for diagnosis if blood and marrow tests are inconclusive. Flow cytometry of blood and marrow cells is useful for diagnosis in experienced individuals. * WHO classification system for the diagnosis and differentiation of subtypes of diseases on the basis of blood and bone marrow findings.
MDS criteria with single-lineage dysplasia (MDS-SLD): Blood: monocytopenia or leukopenia
Bone marrow: dysplasia in ≥ 10% of a cell line, < 5% blast
MDS criteria with erythroid progenitors (MDS-RS): Blood: anemia, no blast
Bone marrow: ≥ 15% erythroid progenitors with cyclic accessory cells, or ≥ 5% cyclic accessory cell progenitors if SF3B1
mutation is present MDS criteria with multilinear dysplasia (MDS-MLD): Blood: cytopenia, <1 × 10 9/L monocytes
Bone marrow: dysplasia in ≥ 10% cells in ≥ 2 hematopoietic lines; <15% cyclic adnexal cells (or <5% if SF3B1 mutations are present), <5% blasts
Do MDS criteria exceed destructive criteria -1 (MDS-EB-1) ): Blood: reduced cell(s) ≤ 2-4% blast, <1 × 10 9/L monocytes
Bone marrow: monoclonal or polyclonal dysplasia, no Auer rods, blast 5-9 %
MDS criteria exceed destructive criteria -2 (MDS-EB-2): Blood: decreased cell(s), 5-19% blast, <1 × 10 9/L monocytes
Bone marrow: single- or multi-linear dysplasia, rod ± Auer, blast 10-19%
Criteria for myelodysplastic syndrome - unclassified (MDS-U): Blood: cytopenia, ± 1% blast at least 2 times
Bone marrow: monoclonal dysplasia or nondysplasia but characteristic cytogenetic -MDS, <5% blast
myelodysplastic syndrome associated with distinct del (5q) criteria : Blood: anemia, normal or elevated platelet levels
Bone marrow: monoclonal erythroid dysplasia, isolated delta (5q), blast <5% ± one other abnormality except -7/del (7q)
Please dial HOTLINE for more information or register for an appointment HERE. Download MyVinmec app to make appointments faster and to manage your bookings easily.
References: healthline.com, emedicine.medscape.com