Bài viết bởi các bác sĩ của Viện nghiên cứu Tế bào gốc và Công nghệ gen Vinmec
Tế bào đơn nhân tủy xương là tập hợp các tế bào không đồng nhất, bao gồm các tế bào dòng tủy, tế bào dòng lympho và là nguồn chứa các tế bào gốc như tế bào gốc tạo máu và tế bào gốc trung mô. Hiện nay, tế bào đơn nhân tủy xương được ứng dụng lâm sàng rất nhiều trong y học tái tạo và đem lại cơ hội điều trị bệnh tích cực cho tất cả mọi người.
1. Tế bào đơn nhân tủy xương là gì?
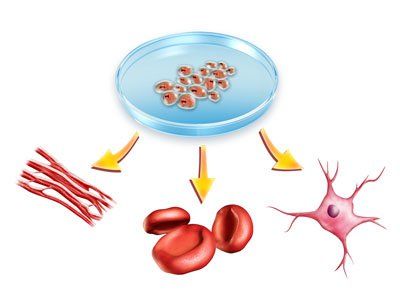
Tế bào đơn nhân tủy xương (Bone marrow-derived mononuclear cells, BMMNCs) là tập hợp các tế bào không đồng nhất, bao gồm các tế bào dòng tủy (bạch cầu đơn nhân và tế bào tua), tế bào dòng lympho (tế bào lympho T, tế bào lympho B và tế bào giết tự nhiên) và là nguồn chứa các tế bào gốc như tế bào gốc tạo máu và tế bào gốc trung mô (Mesenchymal stem cell, MSC) và tế bào tiền thân nội mô (Suda et al., 2017) (Hình 1). BMMNCs được dễ dàng tách chiết từ dịch hút tủy xương bằng phương pháp ly tâm tỷ trọng.
Xem ngay: Ghép tế bào gốc đơn nhân từ tủy xương để điều trị loạn sản phế quản phổi: Báo cáo ca điều trị
2. Cơ chế hoạt động của tế bào đơn nhân tủy xương
Cơ chế hoạt động chính của BMMNCs là kích thích hình thành mạch máu thông qua việc sản sinh ra các yếu tố hình thành mạch máu như yếu tố phát triển nội mô mạch (VEGF), yếu tố tăng trưởng nguyên bào sợi (bFGF), angiopoetin-1, tăng mật độ vi mạch (Jeon at al., 2007) và tác dụng điều hòa miễn dịch. Nghiên cứu gần đây cho thấy BMMNCs tương tác với các tế bào nội mô bằng cách truyền các phân tử nhỏ vào tế bào này giúp làm tăng quá trình hấp thu VEGF và ức chế quá trình autophagy của tế bào nội mô (Kikuchi-Taura et al., 2020). Thông qua cơ chế cận tiết, BMMNCs giảm viêm bằng cách ức chế các cytokine viêm IL-6, TNF-a và IL-1b giúp giảm đau thần kinh (Takamura et al., 2020), tiết cytokine giúp cải thiện khả năng co rút của cơ tim bị thiếu máu (Jackson et al., 2001; Nishida et al., 2003), giảm IL-6, KC và IL-10 giúp giảm quá trình xơ hóa phổi (Araújo at al., 2010).
Các nghiên cứu khác cũng chứng minh rằng các tế bào gốc có nguồn gốc từ tủy xương tiết ra các yếu tố hướng thần kinh như nerve growth factor, neurotrophin-3, glial cell line-derived neurotrophic factor, fibroblast growth facor-2 và insulin-like growth factor type 1 (Pisati et al., 2007; Boucherie et al., 2008; Crisostomo et al., 2008). Ngoài ra, MSC từ tủy xương tiết ra brain-derived neurotrophic factor, giúp bảo vệ các neuron thần kinh (Wilkins et al., 2009). Mặt khác, BMMNCs có khả năng di trú và biệt hóa thành nhiều tế bào khác nhau. BMMNCs được chứng minh có thể di trú tới các vùng bất thường của não và biệt hóa thành các tế bào thần kinh và tế bào glia (Darabi et al., 2013; Song et al., 2007). Sakaida và cộng sự báo cáo rằng BMMNCs có khả năng biệt hóa thành các tế bào sản sinh ra Albumin nhằm cải thiện chức năng của gan (Sakaida et al., 2005). BMMNCs cũng được chứng minh có thể biệt hóa thành các tế bào nội mô và tế bào cơ tim trong cơ thể giúp tái tạo mạch tim và cơ tim, cải thiện chức năng của tim bị tổn thương (Muru et al., 2004; Balsam et al., 2015). Ngoài các cơ chế trên, BMMNCs còn có khả năng ức chế quá trình chết theo chương trình của các tế bào như tế bào cơ tim giúp cải thiện chức năng của tim trong nhồi máu cơ tim (Takahashi et al., 2006) và tế bào ở phổi, thận và gan ở bệnh tổn thương phổi cấp (Araújo at al., 2010).
Xem ngay: Liệu pháp ghép tế bào đơn nhân từ tủy xương tự thân trong điều trị di chứng thần kinh do ảnh hưởng của chảy máu não ở trẻ sơ sinh

3. Ứng dụng lâm sàng của tế bào đơn nhân tủy xương trong y học tái tạo
BMMNCs đã và đang được nghiên cứu, ứng dụng lâm sàng trên nhiều bệnh thần kinh như tự kỷ, bại não, chấn thương sọ não, chấn thương cột sống, đột quỵ. Sharma và cộng sự (2013) đã chứng minh rằng tiêm BMMNCs vào khoang tủy sống là an toàn và giúp cải thiện cải thiện tích cực thang điểm Childhood Autism Rating Scale (CARS), Indian Scale for Assessment of Autism (ISSA) và Clinical Global Impression (CGI), cải thiện chức năng của não, tăng chuyển hóa não, cải thiện khả năng giao tiếp, vận động, hành vi và viết chữ của bệnh nhân mắc chứng rối loạn phổ tự kỷ.
Năm 2020, nhóm nghiên cứu Sharma đã kết hợp tiêm BMMNCs vào khoang tủy sống và phục hồi chức năng thần kinh cho thấy có sự cải thiện đáng kể chứng rối loạn phổ tự kỷ trên 254 trẻ, giúp cải thiện 95% bệnh nhân mắc bệnh bại não. Sharma và đồng nghiệp (2018 và 2020) cũng chỉ ra rằng tiêm BMMNCs vào khoang tủy sống giúp cải thiện cân bằng đi/đứng, khả năng vận động trên giường bệnh, cảm giác, chức năng của tay, cải thiện chỉ số Functional Independence Measure (FIM) và Walking Index for Spinal Cord Injury (WISCI) ở bệnh nhân chấn thương tủy sống. Truyền BMMNCs cùng với vật liệu sinh học NeuroRegen scaffolds giúp cải thiện một phần chức năng thần kinh cảm giác và thần kinh thực vật, tăng tính liên tục (continuity) của tủy sống bị tổn thương do chấn thương tủy sống hoàn toàn cấp tính (Chen et al., 2020). Bên cạnh đó, truyền BMMNCs được chứng minh giúp giảm chỉ số Pediatric Intensity Level of Therapy (PILOT) ở trẻ em (Liao et al., 2015), giúp duy trì cấu trúc mô não và giảm viêm ở người lớn (Cox et al., 2017) mắc chấn thương sọ não nghiêm trọng. BMMNCs cũng giúp cải thiện các triệu chứng bệnh như cân bằng đứng/ngồi, trí nhớ, vận động, cải thiện chỉ số FIM, trao đổi chất ở não, giảm chứng lên cơn ở bệnh nhân chấn thương sọ não mãn tính (Sharma et al., 2020). Truyền động mạch và tĩnh mạch BMMNCs được chứng minh là an toàn và có thể thực hiện được ở bệnh nhân đột quỵ và nhồi máu não cấp (Moniche et al., 2015; Savitz et al., 2011). Gần đây, Haque và cộng sự báo cáo rằng BMMNCs giúp cải thiện khả năng đi bộ, cân bằng đi đứng, chức năng của tay, giúp giảm tổn thương chất trắng ở bệnh nhân đột quỵ (Haque et al., 2021).
Ngoài các bệnh thần kinh, BMMNCs cũng được nghiên cứu ứng dụng trên các các bệnh khác. Terai và cộng sự (2006) cho thấy rằng truyền BMMNCs qua mạch máu ngoại vi giúp tăng lượng Albumin và protein tổng số của huyết thanh, cải thiện chỉ số Child-Pugh ở bệnh nhân xơ gan. Tiêm bắp BMMNCs phục hồi tốc độ dẫn truyền thần kinh vận động và cảm giác (Kim et al., 2009), cải thiện chứng tăng cảm đau cơ học, loạn cảm đau do lạnh và chức năng của thần kinh ở bệnh nhân mắc bệnh thần kinh ngoại biên do đái tháo đường (Naruse et al., 2011). Tiêm động mạch BMMNCs cũng được chứng minh là an toàn và cải thiện lâu dài chức năng của cơ tim ở bệnh nhồi máu cơ tim (Cao et al., 2009), giảm lên cơn, tăng khả năng ghi nhớ ở bệnh nhân mắc bệnh động kinh thùy thái dương (Dacosta et al., 2018). Emadedin và cộng sự (2019) đã truyền tế bào CD133 có nguồn gốc từ tủy xương giúp giảm đau ở bệnh nhân bị thoái hóa vô mạch chỏm xương đùi. Truyền tĩnh mạch BMMNCs cũng được chứng minh giúp giảm viêm, tái tạo và cải thiện chức năng của phổi ở bệnh nhân hen suyễn nặng (Aguiar et al., 2020).
Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.
TÀI LIỆU THAM KHẢO
- Suda, S. Chapter 1- Bone Marrow-Derived Mononuclear Cells. In Cell Therapy Against Cerebral Stroke: Comprehensive Reviews for Translational Researches and Clinical Trials, Houkin, K., Abe, Koji, Kuroda, Satoshi Ed.; Springer: 2017.
- Kikuchi-Taura, A.; Okinaka, Y.; Takeuchi, Y.; Ogawa, Y.; Maeda, M.; Kataoka, Y.; Yasui, T.; Kimura, T.; Gul, S.; Claussen, C.J.S. Bone Marrow Mononuclear Cells Activate Angiogenesis via Gap Junction–Mediated Cell-Cell Interaction. 2020, 51, 1279-1289.
- Boucherie, C.; Caumont, A.-S.; Maloteaux, J.-M.; Hermans, E.J.E.n. In vitro evidence for impaired neuroprotective capacities of adult mesenchymal stem cells derived from a rat model of familial amyotrophic lateral sclerosis (hSOD1G93A). 2008, 212, 557-561.
- Wilkins, A.; Kemp, K.; Ginty, M.; Hares, K.; Mallam, E.; Scolding, N.J.S.c.r. Human bone marrow-derived mesenchymal stem cells secrete brain-derived neurotrophic factor which promotes neuronal survival in vitro. 2009, 3, 63-70.
- Takamura, H.; Terashima, T.; Mori, K.; Katagi, M.; Okano, J.; Suzuki, Y.; Imai, S.; Kojima, H.J.M.T.-M.; Development, C. Bone-Marrow-Derived Mononuclear Cells Relieve Neuropathic Pain after Spinal Nerve Injury in Mice. 2020, 17, 657-665
- Darabi, S.; Tiraihi, T.; Delshad, A.; Sadeghizadeh, M.J.I.b.j. A new multistep induction protocol for the transdifferentiation of bone marrow stromal stem cells into GABAergic neuron-like cells. 2013, 17, 8.
- Sharma, A.K.; Gokulchandran, N.; Kulkarni, P.P.; Sane, H.M.; Sharma, R.; Jose, A.; Badhe, P.B.J.A.J.o.S.C. Cell transplantation as a novel therapeutic strategy for autism spectrum disorders: a clinical study. 2020, 9, 89.
- Sharma, A.; Sane, H.; Gokulchandran, N.; Kulkarni, P.; Jose, A.; Nair, V.; Das, R.; Lakhanpal, V.; Badhe, P.J.I.j.o.h.s. Intrathecal transplantation of autologous bone marrow mononuclear cells in patients with sub-acute and chronic spinal cord injury: An open-label study. 2020, 14, 24.
- Haque, M.E.; Hasan, K.M.; George, S.; Sitton, C.; Boren, S.; Arevalo, O.D.; Vahidy, F.; Zhang, X.; Cox Jr, C.S.; Alderman, S.J.S.c.t.m. Longitudinal neuroimaging evaluation of the corticospinal tract in patients with stroke treated with autologous bone marrow cells. 2021.
- Aguiar, F.S.; Melo, A.S.; Araújo, A.M.S.; Cardoso, A.P.; de Souza, S.A.L.; Lopes-Pacheco, M.; Cruz, F.F.; Xisto, D.G.; Asensi, K.D.; Faccioli, L.J.S.c.r.; et al. Autologous bone marrow-derived mononuclear cell therapy in three patients with severe asthma. 2020, 11, 1-9.