Bài viết bởi Thạc sĩ, Bác sĩ Mai Viễn Phương - Bác sĩ nội soi tiêu hóa - Khoa Khám bệnh & Nội khoa - Bệnh viện Đa khoa Quốc tế Vinmec Central Park
Vi khuẩn HP là nguyên nhân chính gây bệnh viêm loét dạ dày và khối u ác tính. Gần đây, một số nghiên cứu in vitro và in vivo để phát triển liệu pháp quang động kháng H.pylori để diệt trừ H. pylori đã thành công. Bên cạnh đó việc phát triển vắc-xin phòng ngừa vi khuẩn HP cũng đang được nghiên cứu và thử nghiệm đã có thấy tiềm năng.
1. Vi khuẩn Helicobacter Pylori gây bệnh gì?
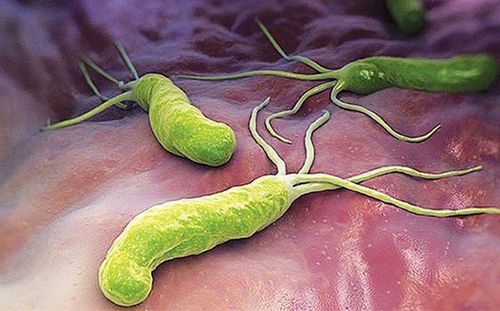
Helicobacter pylori (H. pylori) có hình xoắn ốc với trùng roi, gram âm, vi khuẩn ưa khí sinh sống trong niêm mạc dạ dày của con người và quá trình nhiễm trùng có thể kéo dài hàng thập kỷ.
Theo đó, vi khuẩn HP là nguyên nhân chính quan trọng gây ra bệnh loét dạ dày tá tràng và các khối u ác tính ở dạ dày như u lympho mô liên kết niêm mạc và ung thư biểu mô tuyến dạ dày trên toàn thế giới. Việc điều trị H. pylori vẫn còn là một thách thức, vì có nhiều yếu tố quyết định đến sự thành công của liệu pháp như kháng thuốc kháng sinh chính hoặc phụ, nồng độ thuốc trên niêm mạc, sự tuân thủ của bệnh nhân, các tác dụng phụ và chi phí.
2. Vấn đề về kháng sinh trong điều trị vi khuẩn HP
Mặc dù có số lượng nghiên cứu, phương pháp điều trị tối ưu cho nhiễm H. pylori vẫn chưa được tìm ra và các phương pháp điều trị lâm sàng thường quy thường là liệu pháp kháng sinh ba hoặc bốn thuốc.
Tỷ lệ kháng kháng sinh đối với các loại kháng sinh khác nhau ở các vùng địa lý khác nhau và có liên quan đến việc tiêu thụ kháng sinh ở các khu vực đó. Các kháng sinh được sử dụng phổ biến nhất là imidazole (metronidazole hoặc tinidazol), macrolide (clarithromycin hoặc azithromycin), tetracycline, amoxicillin, rifabutin và furazolidon. Bismuth. Một thuốc chống hoạt tính của Hpylori được sử dụng trong liệu pháp bốn thuốc dựa trên bismuth và gần như hoàn toàn duy trì tỷ lệ tiệt trừ cao, không phụ thuộc vào vấn đề kháng kháng sinh.
Một khảo sát về tình trạng kháng kháng sinh đối với 4 loại kháng sinh thường được sử dụng chống lại H. pylori ở Việt Nam từ tháng 7 năm 2012 đến tháng 1 năm 2014 cho thấy 42,4% kháng với clarithromycin, 41,3% với levofloxacin, 76,1% với metronidazole và 1,1% với amoxicillin.
Một nghiên cứu cắt ngang với việc thu thập các mẫu sinh thiết dạ dày ở Hoa Kỳ từ năm 2009 đến năm 2013 cho thấy tỷ lệ H. pylori đề kháng với levofloxacin là 31,3%, với metronidazole là 20,3%, với clarithromycin là 16,4% và với tetracycline. là 0,8%. Không có chủng nào biểu hiện kháng amoxicillin, nhưng kháng clarithromycin tăng từ 9,1% năm 2009-2010 lên 24,2% năm 2011-2013.
Kết quả về tình trạng kháng kháng sinh trong hai lần, lần thứ nhất (2000) và lần thứ hai (2010) ở Hy Lạp cho thấy trong thời gian đầu, 30% và 0% bệnh nhân bị nhiễm các chủng kháng clarithromycin hoặc quinolon nhưng, lần thứ hai (2010), tỷ lệ đề kháng với clarythromycin hoặc quinolon lần lượt tăng lên 42% và 5,3%.
Một cuộc đánh giá có hệ thống các tài liệu về tình trạng kháng kháng sinh của H. pylori được thực hiện ở Iran trong khoảng thời gian từ năm 1997 đến năm 2013. Mức độ đề kháng của H. pylori với các loại kháng sinh khác nhau, bao gồm metronidazole, clarithromycin, furazolidone, amoxicillin, tetracycline, ciprofloxacin, levofloxacin Lần lượt là 61,6%, 22,4%, 21,6%, 16,0%, 12,2%, 21,0% và 5,3% [21]. So sánh kết quả từ các quốc gia khác nhau cho thấy tỷ lệ H. pylori đề kháng với các loại kháng sinh khác nhau là không giống nhau và có thể thay đổi theo thời gian ngay cả trong cùng một quần thể.
Nhiều bằng chứng chỉ ra rằng để xác định một loại kháng sinh thích hợp trong phác đồ thuốc chống nhiễm trùng H. pylori, cần có thông tin về tính nhạy cảm với kháng sinh của vi khuẩn này trong các khu vực địa lý khác nhau trên thế giới.
3. Liệu pháp quang động học trong điều trị vi khuẩn HP
Sự bất hoạt quang động của vi sinh vật dựa trên sự kết hợp của thuốc nhuộm được gọi là chất nhạy cảm. Chất nhạy cảm và ánh sáng nhìn thấy vô hại có bước sóng thích hợp để tạo ra trạng thái kích thích bộ ba (3O2) của các phân tử thuốc nhuộm, đến lượt nó, có thể phản ứng với oxy phân tử dẫn đến sản xuất các loại oxy phản ứng độc tế bào khác nhau như gốc superoxide-anion (O2 • -) và oxy phân tử đơn (1O2).
Gần đây, một số nghiên cứu in vitro và in vivo để phát triển liệu pháp quang động kháng H.pylori để diệt trừ H. pylori đã thành công.
Trong một nghiên cứu trong ống nghiệm, một chất cảm quang như Chlorin e6 (Ce6) như một sản phẩm tự nhiên được khử từ chất diệp lục, được sử dụng để đạt được điều kiện chiếu xạ tối ưu như nồng độ Ce6 ban đầu, thời gian ủ, cường độ ánh sáng và thời gian tiếp xúc để khử hoạt tính hiệu quả H. pylori. Sự bất hoạt quang động của H. pylori bằng cách sử dụng Ce6 cho thấy rằng thời gian chiếu xạ tiếp xúc, tiếp theo là cường độ ánh sáng và nồng độ Ce6 là nguyên nhân chính gây bất hoạt các chủng. Hamblin và cộng sự đã chứng minh nhiều chủng H. pylori bị tiêu diệt trong ống nghiệm bằng tác động quang động khi chiếu sáng.
H. pylori nhạy cảm với sự bất hoạt bởi ánh sáng xanh, điều này có thể đại diện cho một phương pháp điều trị mới, đặc biệt ở những bệnh nhân thất bại với liệu pháp kháng sinh tiêu chuẩn. Đèn chiếu ánh sáng xanh tạo ra sự suy giảm nhanh chóng số lượng vi khuẩn trong ánh sáng xanh được phân phối nội soi trong dạ dày của 10 bệnh nhân dương tính với H. pylori.

Dựa trên một nghiên cứu thử nghiệm tiềm năng, có kiểm soát, phương pháp quang trị liệu bằng ánh sáng tím trong dạ dày là an toàn và khả thi và có thể chứng minh một cách tiếp cận mới để tiệt trừ H. pylori, đặc biệt ở những bệnh nhân đã thất bại với liệu pháp kháng sinh tiêu chuẩn.
Choi và cộng sự đã áp dụng ánh sáng trắng nội soi và thuốc nhuộm xanh methylen cho thấy hiệu quả kháng khuẩn ấn tượng đối với H. pylori. Cơ chế chính của tác dụng diệt khuẩn đã được chứng minh là gây tổn thương DNA do oxy hóa của H. pylori.
Liệu pháp quang động trong ống nghiệm chống lại H. pylori bằng cách sử dụng ánh sáng nội soi (NBI và ánh sáng trắng thông thường), với nồng độ thấp hoặc cao của protoporphyrin IX làm chất cảm quang cho thấy các hoạt động diệt khuẩn rất hiệu quả và cơ chế chính của liệu pháp quang động này là làm tổn thương tế bào màng.
Theo kết quả, cần phải thực hiện liệu pháp quang động in vivo bằng cách sử dụng mô hình bệnh tật của động vật và chỉ ra những hạn chế và hiệu quả của kỹ thuật mới này. Ngoài ra, chi phí, tác dụng phụ và tính dễ sử dụng cũng nên được tính đến và phát triển các vật liệu cảm quang mới để cải thiện hoạt tính kháng khuẩn hoặc sử dụng ánh sáng có bước sóng cụ thể cho chất cảm quang thay vì ánh sáng có phổ bước sóng rộng.
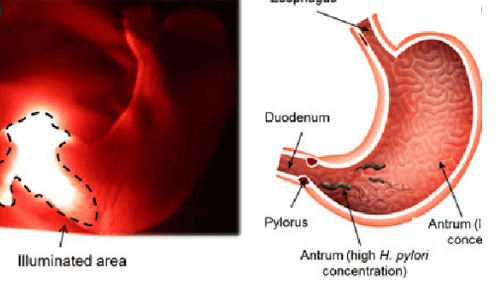
4. Vắc-xin phòng ngừa nhiễm vi khuẩn HP
Tất cả các loài H. pylori trong dạ dày đều dương tính với men urease xúc tác quá trình thủy phân urê. UreB là đơn vị hoạt động của men urease tương đối bảo tồn và nó có tính kháng nguyên rất mạnh và là yếu tố quan trọng cho sự tồn tại và sinh sống của vi khuẩn trong điều kiện có tính axit của dạ dày. UreI, một protein kênh urê của H. pylori là yếu tố chính cho sự xâm nhập của vi khuẩn trong dạ dày động vật có vú có tính axit. Trong một nghiên cứu, vắc-xin đa biểu mô được thiết kế bằng cách ghép hai đoạn kháng nguyên (UreB và UreI) của H. pylori và tiểu đơn vị B của độc tố tả (CTB), dẫn đến hiệu quả bảo vệ đáng kể chống lại sự thách thức của H. pylori ở chuột BALB / c.
Cả tiêm bắp và uống kháng nguyên đa biểu mô, UreI và UreB, với CTB đều có tác dụng bảo vệ miễn dịch chống lại sự thách thức của H. pylori, và đường uống có tỷ lệ bảo vệ chống nhiễm trùng cao hơn đối với H. pylori.
Một số protein khác của H. pylori đã được báo cáo là kháng nguyên vắc-xin hiệu quả như gen A liên kết với cytotoxin, không bào độc tố A (Vac A) protein sốc nhiệt, protein hoạt hóa bạch cầu trung tính, bề mặt- protein bản địa hóa HpaA, v.v. Có thể xảy ra sự kết hợp của một số kháng nguyên đã đề cập với nhau hoặc với chất bổ trợ thích hợp có thể tạo ra tác dụng bảo vệ thông qua tiêm chủng.
Gần đây, một phương pháp tiêm chủng ngược được sử dụng để dự đoán các ứng cử viên vắc xin tiềm năng chống lại H. pylori và tìm kiếm các kháng nguyên mới bằng cách sử dụng các phương pháp tính toán hoặc tin sinh học. Trong nghiên cứu này, 5 biểu mô kháng nguyên bao gồm protein bám dính babA, sabA, omp16, protein vận chuyển sắt (III) dicitrate fecA và vacA vô bào độc tố đã được ưu tiên lựa chọn như những ứng cử viên vắc xin tiềm năng chống nhiễm khuẩn H. pylori.
Các kháng thể điều trị là công cụ có giá trị trong việc nhắm mục tiêu một loạt các bệnh đường ruột và mầm bệnh trong suốt nhiều năm. Một nghiên cứu gần đây của Den Hoed và cộng sự đã chỉ ra rằng liệu pháp miễn dịch uống dựa trên kháng thể bò được dung nạp tốt, nhưng không làm giảm đáng kể mật độ H. pylori trong dạ dày ở người.
Việc tạo ra và ứng dụng các hạt giống virus và hạt nano với kháng nguyên hấp phụ bề mặt có thể tạo ra các phản ứng miễn dịch mạnh mẽ của tế bào T và B sẽ là một công cụ hữu ích cho việc phát triển vắc xin. Việc phát triển vắc-xin an toàn và hiệu quả chống lại nhiễm H. pylori trở nên đặc biệt quan trọng.
Việc sử dụng kháng sinh như là liệu pháp đầu tay có thể phù hợp nếu chúng được lựa chọn dựa trên các nghiên cứu trên toàn quốc về các mô hình kháng thuốc kháng sinh tại địa phương và khu vực. Việc phát triển các loại thuốc kháng sinh thay thế để diệt trừ H. pylori sẽ là một tiến bộ vô giá, mặc dù phải mất nhiều năm trước đó để đánh giá những phân tử có khả năng thú vị này ở người.
Điều trị bổ trợ với men vi sinh được khuyến khích do điều hòa miễn dịch, kích thích sản xuất mucin và ức chế sự xâm nhập và sự tồn tại của H. pylori. Mặt khác, các lựa chọn tiềm năng như cây thuốc, liệu pháp quang động học và vắc xin vẫn đang trong giai đoạn thử nghiệm.
Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.
Tài liệu tham khảo
1. Lv ZF, Wang FC, Zheng HL, Wang B, Xie Y, Zhou XJ, Lv NH. Meta-analysis: is combination of tetracycline and amoxicillin suitable for Helicobacter pylori infection? World J Gastroenterol. 2015;21:2522-2533. [PubMed] [DOI]
2. Hajimahmoodi M, Shams-Ardakani M, Saniee P, Siavoshi F, Mehrabani M, Hosseinzadeh H, Foroumadi P, Safavi M, Khanavi M, Akbarzadeh T. In vitro antibacterial activity of some Iranian medicinal plant extracts against Helicobacter pylori. Nat Prod Res. 2011;25:1059-1066. [PubMed] [DOI]
3. Buzás GM. Metabolic consequences of Helicobacter pylori infection and eradication. World J Gastroenterol. 2014;20:5226-5234. [PubMed] [DOI]
4. Gu H, Li L, Gu M, Zhang G. Association between Helicobacter pylori Infection and Chronic Urticaria: A Meta-Analysis. Gastroenterol Res Pract. 2015;2015:486974. [PubMed] [DOI]
5. Ben Chaabane N, Al-Adhba HS. Ciprofloxacin-containing versus clarithromycin-containing sequential therapy for Helicobacter pylori eradication: A randomized trial. Indian J Gastroenterol. 2015;34:68-72. [PubMed]
6. Olokoba AB, Obateru OA, Bojuwoye MO. Helicobacter pylori eradication therapy: A review of current trends. Niger Med J. 2013;54:1-4. [PubMed] [DOI]
7. Maliheh Safavi, và cộng sự, Treatment of Helicobacter pylori infection: Current and future insights. World J Clin Cases. Jan 16, 2016; 4(1): 5-19