Bài viết bởi Bác sĩ Mai Viễn Phương - Khoa Khám bệnh & Nội khoa, Bệnh viện Đa khoa Quốc tế Vinmec Central Park
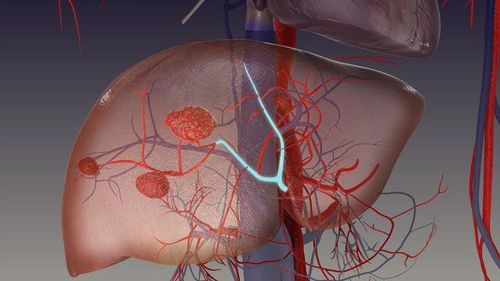
U máu gan (HH) là một khối u có nguồn gốc từ trung bì bao gồm một không gian chứa đầy máu, được nuôi dưỡng bởi tuần hoàn động mạch gan và được lót bởi một lớp tế bào nội mô phẳng. Đây là loại u gan lành tính phổ biến nhất, biểu hiện như một tổn thương có tăng sinh mạch máu được mô tả rõ ràng, thường thấy ở phụ nữ với tỷ lệ dao động từ 0,4% đến 7,3% (dựa trên kết quả khám nghiệm tử thi) và tỷ lệ mắc bệnh là 0,4% -20% ở dân số chung.
1. Tổng quan
U máu gan (HH) là khối u gan lành tính phổ biến nhất và nó thường được phát hiện tình cờ trong các đợt khám sức khoẻ. Khối u này phát sinh từ một dị dạng mạch máu; tuy nhiên, sinh lý bệnh vẫn chưa được làm sáng tỏ rõ ràng. Các triệu chứng thường tương quan với kích thước và vị trí của khối u. Ít phổ biến hơn là sự hiện diện của U máu gan lớn có thể gây ra các tình trạng đe dọa tính mạng.
Chẩn đoán có thể được thiết lập bằng cách xác định các dấu hiệu u máu gan trong một số xét nghiệm chẩn đoán hình ảnh. Ở những bệnh nhân có các triệu chứng ở bụng, các nguyên nhân khác nên được loại trừ trước tiên trước khi quy u máu gan là nguyên nhân. Đối với bệnh nhân không có triệu chứng, không cần điều trị và theo dõi thường dành cho u máu gan trên 5 cm.
2. Triệu chứng u máu gan
U máu gan thường không có triệu chứng, tuy nhiên các triệu chứng có thể xuất hiện khi HH lớn hơn> 5 cm . Các triệu chứng không đặc hiệu, bệnh nhân thường mô tả đau bụng, khó chịu và đầy tức vùng hạ sườn phải, thứ phát do căng và viêm nang Glisson. Có khối u> 10 cm kèm theo chướng bụng . Vị trí của khối gan có thể gây áp lực và chèn ép các cấu trúc lân cận gây ra các triệu chứng khác như buồn nôn, no sớm và chướng bụng sau ăn. Các triệu chứng ít gặp hơn bao gồm sốt, vàng da, khó thở, suy tim cung lượng cao và huyết thanh .
U máu gan khổng lồ có thể gây ra rối loạn đông máu đe dọa tính mạng được gọi là hội chứng Kasabach-Merrit (giảm tiểu cầu, đông máu lan tỏa trong lòng mạch và chảy máu hệ thống) với rối loạn đông máu thứ phát sau giảm tiểu cầu, thiếu máu, giảm fibrinogenimia, giảm thời gian prothrombin và tăng D-dimer . Hội chứng này đã được báo cáo với tỷ lệ mắc bệnh từ 0,3% tổng số HH đến 26% ở các khối u> 15 cm.
Một biến chứng nghiêm trọng khác là chảy máu do vỡ tự phát hoặc do chấn thương (ở các tổn thương khổng lồ nằm ở ngoại vi và ngoại vi), tuy nhiên nguy cơ là cực kỳ thấp (0,47%)
3. Điều trị u máu gan
U máu gan nhỏ, không có triệu chứng không cần điều trị hoặc theo dõi. Một số tác giả đề nghị theo dõi u máu gan > 5 cm ở 6-12 tháng để đánh giá tăng trưởng nhanh với cùng một xét nghiệm hình ảnh được sử dụng khi chẩn đoán .
Nên hạn chế điều trị cho những bệnh nhân có triệu chứng, với khối lượng phát triển liên tục, chèn ép các cơ quan lân cận (tắc nghẽn đường ra dạ dày, hội chứng Budd-Chiari) hoặc các biến chứng như vỡ do chảy máu trong phúc mạc hoặc hội chứng Kasabach-Merrit.
Đau bụng nên được đánh giá cẩn thận ở bệnh nhân u máu gan và các nguyên nhân có thể xảy ra khác nên được ghi nhớ trước khi quyết định điều trị dứt điểm. Farges và cộng sự chẩn đoán 87 bệnh nhân bị đau bụng và u máu gan, trong số này, 54% được phát hiện có các bệnh lý khác do đau bụng. Điều trị cụ thể cho đau bụng và u máu gan được yêu cầu ở 14 bệnh nhân và một nửa trong số họ vẫn còn triệu chứng sau khi điều trị, cho thấy căn nguyên khác gây ra cơn đau. Trong một nghiên cứu khác, phần lớn bệnh nhân bị đau bụng và u máu gan được phát hiện có các triệu chứng liên quan đến các bệnh đường tiêu hóa khác nhau (Hội chứng ruột kích thích, trào ngược dạ dày thực quản, viêm gan, loét dạ dày tá tràng, bệnh túi mật) và chỉ có 21,7% bệnh nhân có triệu chứng, bụng nỗi đau là do u máu gan .
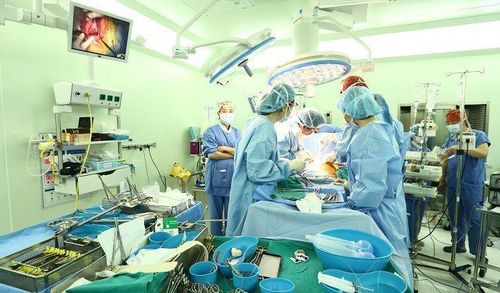
3.1 Phẫu thuật
Phẫu thuật tiếp tục là phương pháp điều trị phổ biến nhất cho u máu gan. Xử trí phẫu thuật bao gồm cắt gan, ghép nhân, thắt động mạch gan và ghép gan. Các thủ thuật phổ biến nhất trên toàn thế giới là cắt và ghép gan (mổ hở, nội soi hoặc robot) .
Ca cắt bỏ gan đầu tiên cho u máu gan được thực hiện vào năm 1987 bởi Schwartz và cộng sự và vào năm 1988, Alper và cộng sự đã báo cáo chín bệnh nhân đầu tiên được điều trị bằng phương pháp tách hạt.
Việc lựa chọn thủ thuật phụ thuộc vào kích thước, số lượng tổn thương, vị trí, kinh nghiệm của bác sĩ phẫu thuật và nguồn lực của cơ sở. Cả hai kỹ thuật đều mang lại tỷ lệ bệnh tật sau phẫu thuật tối thiểu.
Trong những năm gần đây, một số nghiên cứu đã đánh giá quá trình tách nhân so với phẫu thuật cắt gan và hầu hết đều kết luận rằng chọc dò có liên quan đến tỷ lệ mắc bệnh thấp hơn, thời gian mổ ngắn hơn, mất máu ít hơn và ít biến chứng hơn . Tuy nhiên, khi u máu gan lớn hơn 10 cm, Zhang và cộng sự không tìm thấy sự khác biệt về thời gian phẫu thuật, mất máu, biến chứng hoặc thời gian nằm viện giữa phẫu thuật và cắt bỏ.
Phẫu thuật bóc u máu gan dễ dàng hơn về mặt kỹ thuật ở u máu gan ở ngoại vi, khi thực hiện ở u máu gan ở trung tâm, thủ thuật gây ra thời gian tắc mạch máu lâu hơn, thời gian mổ lâu hơn và mất nhiều máu hơn. U máu gan ở trung tâm (Đoạn I, IV, V và VIII) được điều trị bằng phương pháp cắt gan trái và phải mở rộng. Liệu pháp này có thể loại bỏ 60% đến 80% nhu mô gan, dẫn đến nguy cơ suy gan sau phẫu thuật cao hơn. Một số tổn thương thích hợp để cắt bỏ sụn chêm .
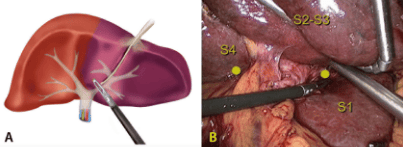
Sự cải tiến trong phẫu thuật nội soi đã làm tăng các trường hợp được điều trị bằng phẫu thuật xâm lấn tối thiểu để cắt bỏ hoặc ghép nhân. Phẫu thuật nội soi gan được ưa thích hơn trong các tổn thương bên trái, nhỏ và phải cắt bỏ nhỏ .
Một nghiên cứu hồi cứu gần đây đã so sánh phẫu thuật gan mở và mổ nội soi cho u máu gan; kết quả ủng hộ liệu pháp nội soi với ít mất máu hơn, tỷ lệ biến chứng thấp hơn và thời gian nằm viện sau phẫu thuật ngắn hơn. Tuy nhiên, các đặc điểm cơ bản của bệnh nhân giữa hai nhóm không bằng nhau do bác sĩ phẫu thuật quyết định phẫu thuật mở hay mổ nội soi dựa trên đặc điểm khối u .
Ghép gan cho các khối u rắn lành tính không được coi là phương pháp điều trị đầu tiên do bệnh tật và thiếu nội tạng. Một nghiên cứu được công bố vào năm 2015 đã phân tích dữ liệu từ United Network of Organ Sharing từ năm 1988 đến 2013 và phát hiện ra 147 (0,17%) ca ghép gan ở bệnh nhân Hoa Kỳ được thực hiện cho các khối u lành tính của gan, trong đó có 25 ca ghép cho cho u máu gan .
Ghép gan dành riêng cho những người khổng lồ không thể cắt bỏ cho u máu gan gây ra các triệu chứng nghiêm trọng (suy hô hấp, đau bụng), thất bại các can thiệp trước đó hoặc các biến chứng nguy hiểm đến tính mạng như hội chứng Kasabach Merrit .
3.2 Điều trị cho u máu gan không phẫu thuật
Thuyên tắc động mạch xuyên (TAE) được sử dụng để kiểm soát chảy máu cấp tính hoặc thu nhỏ cho u máu gan trước khi phẫu thuật bằng cuộn dây kim loại, hạt gel, rượu polyvinyl và các chất lỏng như N-butyl-2-cyanoacrylate, bleomycin-lipiodol . Tuy nhiên, TAE cũng được sử dụng như một phương pháp điều trị đơn lẻ với kết quả chấp nhận được.
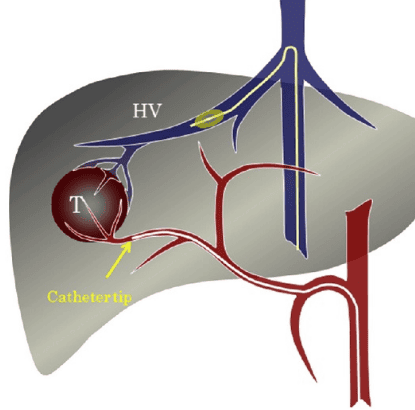
Hỗn hợp pingyangmycin / lipiodol lần đầu tiên được nghiên cứu như một phương pháp điều trị đơn lẻ cho cho u máu gan. Hai nghiên cứu báo cáo kết quả tốt với việc giảm đáng kể thể tích cho u máu gan và giảm các triệu chứng . Pingyagmycin chỉ có ở Trung Quốc, các nghiên cứu tương tự đã được thực hiện ở những nơi khác với bleomycin thay thế cho pingyagmycin.
Một nghiên cứu với 23 bệnh nhân (29 cho u máu gan) được quản lý TAE với bleomycin-lipiodol kết luận 73,9% bệnh nhân có> 50% thể tích HH thoái triển . Sử dụng Bleomycin dẫn đến hình thành vi huyết khối, dẫn đến teo và xơ hóa khối u. Nó cũng gây ra một quá trình viêm không đặc hiệu xung quanh cho u máu gan và trong khu vực cổng. Suy gan cấp, nhồi máu gan, áp xe, u biloma trong gan, viêm túi mật, nhồi máu lách, thủng động mạch gan và viêm đường mật xơ cứng đã được báo cáo là các biến chứng liên quan của TAE với Bleomycin .
Cắt bỏ bằng tần số vô tuyến (RFA) có thể được sử dụng qua da, nội soi hoặc bằng phẫu thuật mở. RFA gây ra sự phá hủy nhiệt đối với các cấu trúc nội mô mạch máu và thúc đẩy hình thành huyết khối. RFA thường được thực hiện theo hướng dẫn của Hoa Kỳ; CT hướng dẫn RFA qua da phù hợp với cho u máu gan nằm sâu trong nhu mô gan.
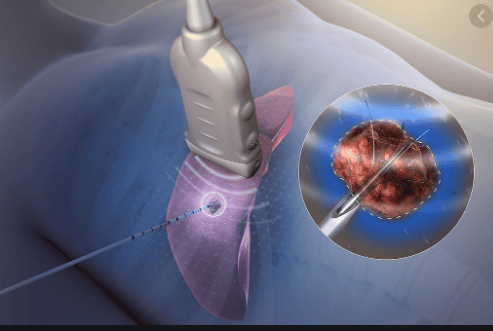
RFA nội soi với sự hướng dẫn của Hoa Kỳ được ưu tiên cho cho u máu gan dưới bao. RFA nội soi so với phẫu thuật mở có liên quan đến thời gian phẫu thuật ngắn hơn, ít đau hơn, thời gian nằm viện ngắn hơn và chi phí nằm viện thấp hơn.
RFA kéo dài dễ gây tán huyết, đái ra huyết sắc tố và tổn thương thận cấp tính, do đó không thích hợp cho cho u máu gan lớn . Các biến chứng khác của RFA bao gồm chảy máu tại vị trí nhập điện cực, vỡ cho u máu gan và tổn thương các cơ quan lân cận do đâm thủng hoặc chấn thương nhiệt.
Các chỉ định được thiết lập cho RFA ở nhóm đối tượng này là đường kính tối đa của cho u máu gan > 5 cm, khối u to lên> 1 cm trong vòng 2 năm, đau bụng dai dẳng liên quan đến cho u máu gan và loại trừ các bệnh GI khác. Chống chỉ định bao gồm bệnh nhân có xu hướng chảy máu nặng, khối u ác tính, hội chứng Kasabach-Merrit, nhiễm trùng (viêm hệ thống mật), chức năng miễn dịch thấp và suy nội tạng nặng.
Việc sử dụng anti-VEGF như sorafenib và bevacizumab đã được báo cáo trong trường hợp các báo cáo tình cờ làm giảm kích thước cho u máu gan. Một nghiên cứu hồi cứu nhằm mục đích nghiên cứu sự giảm kích thước cho u máu gan bằng anti VEGF (bevacizumab hoặc sunitinib) cho thấy không có sự giảm thể tích đáng kể . Metformin cũng đã được báo cáo trong một báo cáo trường hợp làm giảm kích thước cho u máu gan một cách ngẫu nhiên .
3.3 Ghép gan với ghép gan cắt bỏ cho u máu gan
Trong những năm gần đây, tiêu chí ghép gan của người hiến đã được mở rộng để khắc phục tình trạng thiếu nội tạng. Những người hiến gan được cắt bỏ một phần gan từ cho u máu gan đã được chứng minh là một nguồn khả thi để ghép gan với kết quả thụ thể chấp nhận được và cho u máu gan không phát triển.
4. Kết luận
Hầu hết cho u máu gan được chẩn đoán tình cờ trong các xét nghiệm hình ảnh vì hầu hết bệnh nhân không có triệu chứng trong suốt cuộc đời của họ. Những bệnh nhân có các triệu chứng thường là do các tổn thương lớn hơn.
Vì tiền sử tự nhiên của cho u máu gan là lành tính và sự gia tăng tiến triển kích thước xảy ra dưới 40%, hầu hết bệnh nhân có thể yên tâm và chỉ quan sát. Khi một bệnh nhân có triệu chứng, bước đầu tiên là loại trừ các nguyên nhân khác gây ra các triệu chứng của họ. Một khi loại trừ các căn nguyên khác và cho u máu gan được coi là nguyên nhân của các triệu chứng, các phương thức điều trị được quyết định dựa trên kích thước, giải phẫu và các bệnh đi kèm của bệnh nhân.
Trong những năm qua, các thủ thuật xâm lấn tối thiểu không phẫu thuật để giảm khối u và phẫu thuật nội soi đã cho kết quả tốt ở một số bệnh nhân được chọn.
Hiếm khi cho u máu gan xuất hiện với các tình trạng đe dọa tính mạng như vỡ do chấn thương cấp tính hoặc rối loạn đông máu. Chỉ trong những trường hợp này, việc xử trí phẫu thuật khẩn cấp mới được đảm bảo.
Bác sĩ lâm sàng nên phân biệt giữa quan sát và xử trí tối ưu tốt nhất dựa trên biểu hiện lâm sàng. Nếu cần điều trị, nên theo đuổi phương pháp xâm lấn tối thiểu. Nghiên cứu trong tương lai sẽ giúp các bác sĩ lâm sàng hiểu cơ chế bệnh sinh cho u máu gan và hướng dẫn xử trí.
Hiện nay Bệnh viện Đa khoa Quốc tế Vinmec có các gói Sàng lọc Gan mật, giúp phát hiện Virus viêm gan ở giai đoạn sớm ngay cả khi chưa có triệu chứng. Ngoài ra, Gói sàng lọc gan mật toàn diện giúp khách hàng:
- Đánh giá khả năng làm việc của gan thông qua các xét nghiệm men gan;
- Đánh giá chức năng mật; dinh dưỡng lòng mạch;
- Tầm soát sớm ung thư gan;
- Thực hiện các xét nghiệm như Tổng phân tích tế bào máu, khả năng đông máu, sàng lọc viêm gan B,C
- Đánh giá trạng thái gan mật qua hình ảnh siêu âm và các bệnh có nguy cơ ảnh hưởng gây ra bệnh gan/làm bệnh gan nặng hơn
- Phân tích sâu các thông số đánh giá chức năng gan mật thông qua xét nghiệm, cận lâm sàng; các nguy cơ ảnh hưởng đến gan và tầm soát sớm ung thư gan mật
Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.
Tài liệu tham khảo
- Ishak KG, Rabin L. Benign tumors of the liver. Med Clin North Am. 1975;59:995-1013. [PubMed] [DOI]
- Yang Z, Tan H, Liu X, Sun Y. Extremely Giant Liver Hemangioma (50 cm) with Kasabach-Merritt Syndrome. J Gastrointest Surg. 2017;21:1748-1749. [PubMed] [DOI]
- Schumacker HB. Hemangioma of the liver: discussion of symptomatology and report of patient treated by operation. Surgery. 1942;11:209–222.
- Reddy KR, Kligerman S, Levi J, Livingstone A, Molina E, Franceschi D, Badalamenti S, Jeffers L, Tzakis A, Schiff ER. Benign and solid tumors of the liver: relationship to sex, age, size of tumors, and outcome. Am Surg. 2001;67:173-178. [PubMed]
- Hasan HY, Hinshaw JL, Borman EJ, Gegios A, Leverson G, Winslow ER. Assessing normal growth of hepatic hemangiomas during long-term follow-up. JAMA Surg. 2014;149:1266-1271. [PubMed] [DOI]
- Monica Leon, Luis Chavez, Salim Surani, Hepatic hemangioma: What internists need to know, World J Gastroenterol. Jan 7, 2020; 26(1): 11-20