Rotavirus là nguyên nhân phổ biến nhất gây bệnh tiêu chảy nặng ở trẻ em và trẻ sơ sinh trên toàn thế giới. Cách tốt nhất để phòng tránh bệnh là tiêm chủng vắc-xin. Một loại vắc-xin có tác dụng để ngăn ngừa bệnh đã được cấp phép đầu tiên vào năm 1998 nhưng đã bị rút lại vào năm 1999 do liên quan đến bệnh lồng ruột. Năm 2006, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê chuẩn một loại vắc-xin mới, RotaTeq(của Merch). Năm 2008 FDA phê duyệt tiếp loại thứ hai, Rotarix(của GlaxoSmithKline).
1. Rotavirus là gì?
Rotavirus được bài tiết với số lượng rất lớn trong phân, tương ứng với 1011 virus trên mỗi gam được mô tả. Virus sẽ được truyền qua đường phân - miệng.
Rotavirus rất ổn định trong phân và có thể tồn tại trong nhiều ngày ở nhiệt độ thường. Điều đó khiến chúng dễ truyền lây lan hơn trong các môi trường như trung tâm chăm sóc sức khỏe trẻ em, bệnh viện...
Các nhà nghiên cứu đã thấy rằng rotavirus sao chép trong tế bào ruột của ruột non. Do đó, virus phải truyền sang ruột non để gây ra triệu chứng của bệnh. Sau thời gian ủ bệnh ngắn từ 24 đến 48 giờ, nôn mửa trước khi tiêu chảy sẽ xuất hiện trong hơn một nửa các trường hợp bị nhiễm trùng. Những trường hợp này sau 5-7 ngày bị tiêu chảy cấp có thể dẫn đến mất nước nhanh chóng, tiếp đó là hiện tượng sốt sẽ xảy ra ở khoảng một phần ba trẻ em bị nhiễm bệnh.
Các nghiên cứu lịch sử tự nhiên đã chỉ ra rằng khả năng miễn dịch tự nhiên có được do nhiễm bởi nhiễm trùng hoang dại cung cấp mức độ bảo vệ khỏi bệnh nhiễm trùng có triệu chứng trong tương lai. Và việc phơi nhiễm lặp đi lặp lại sẽ mở rộng sự đáp ứng miễn dịch dị hình đối với các chủng virus khác nhau. Đây chính là tiền đề thiết yếu để vắc-xin rotavirus sống giảm độc lực được phát triển.
2. Vắc-xin rota ra đời và phát triển thế nào?
Vắc-xin đầu tiên được lấy từ bò và khỉ. Các nghiên cứu đã chứng minh rằng những vắc-xin sống dạng uống có thể ngăn ngừa tiêu chảy do rotavirus ở trẻ nhỏ, nhưng hiệu quả rất khác nhau. Do khả năng miễn dịch với protein G (VP7) hoặc P (VP4) có liên quan đến sự bảo vệ và phục hồi bệnh, nên vắc-xin virus sống được phát triển kết hợp protein G hoặc cả protein G và P cho từng loại huyết thanh chiếm ưu thế.
Vào năm 1998, vắc-xin rotavirus hóa trị bốn dựa trên khỉ nâu/khỉ rezut (RRV-TV, Rotashield) đã được cấp phép và khuyến nghị tiêm chủng định kỳ cho trẻ sơ sinh ở Hoa Kỳ. Tuy nhiên, RRV-TV đã bị rút khỏi Hoa Kỳ trong vòng một năm kể từ khi được giới thiệu vì nó có liên quan đến bệnh lồng ruột. Nguy cơ mắc bệnh lồng ruột cao nhất trong vòng 3 đến 14 ngày sau khi nhận được liều vắc-xin RRV-TV đầu tiên, và nguy cơ nhỏ hơn trong vòng 3 đến 14 ngày sau khi nhận liều vắc-xin thứ hai.
Nhìn chung, nguy cơ liên quan đến liều vắc-xin RRV-TV đầu tiên được ước tính là khoảng một trường hợp trên 10,000 người nhận vắc-xin. Một số nhà nghiên cứu cho rằng nguy cơ mắc bệnh lồng ruột liên quan đến liều vắc-xin đầu tiên với sự tăng tuổi khi tiêm.
Hiện nay, có hai loại vắc-xin rota được cấp phép sử dụng tại Hoa Kỳ:
- RV5 (RotaTeq):
Là một loại vắc-xin dạng uống được sản xuất trực tiếp bởi Merch. Đồng thời, cũng được Cục quản lý Thực phẩm và Dược phẩm cấp phép vào tháng 2 năm 2006.
Vắc-xin RotaTeq chứa năm loại rotavirus tái tổ hợp được phát triển từ các chủng rotavirus ở người và bò. Mỗi lọ vắc-xin 2ml chứa khoảng 2x106 đơn vị truyền nhiễm của một trong số năm chủng tái tổ hợp.
Các virus trong vắc-xin sẽ bị đình chỉ trong một dung dịch đệm chứa sucrose, sodium citrate, sodium phosphate monobasic monohydrate, sodium hydroxide, polysorbate 80 và môi trường nuôi cấy mô. Một lượng dấu vết huyết thanh của bào thai bò có thể có mặt trong hỗn hợp này. Vắc-xin không chứa chất bảo quản hoặc Thiomersal.
Khả năng truyền virus vắc-xin không được đánh giá trong các thử nghiệm. Trong một đánh giá sau cấp phép tại Hoa Kỳ, các mẫu phân được thu thập từ trẻ sơ sinh trong 9 ngày đầu tiên. Kháng nguyên rotavirus đã được phát hiện trong phân của 21% trong số 103 trẻ sơ sinh ( từ ngày thứ 3 sau tiêm chủng và muộn nhất là vào ngày thứ 9).
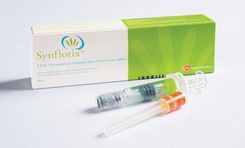
- VRV1 (Rotarix):
Là một loại vắc-xin dạng uống trực tiếp được sản xuất bởi GlaxoSmithKline, đã được FDA cấp phép vào tháng 4 năm 2008.
Vắc-xin Rotarix có chứa chủng rotavirus 89-12 (loại G1P1A). RV1 (Rotarix)được cung cấp dưới dạng bột đông khô và sẽ được hoàn nguyên khi sử dụng. Mỗi liều vắc-xin hoàn nguyên 1ml chứa ít nhất 106 đơn vị truyền nhiễm tế bào nuôi cấy trong bình.
Vắc-xin chứa acid amin, dextran, môi trường trung gian của Dulbecco đã được biến đổi, sorbitol và sucrose. Chất pha loãng chứa canxi cacbonat, nước vô trùng, và xanthan. Vắc-xin không chứa chất bảo quản và Thiomersal.
Việc cắt bỏ phân của kháng nguyên rotavirus được đánh giá trong tất cả hoặc một tập hợp con của bảy nghiên cứu ở các nước khác nhau. Sau liều thứ nhất, sự phát hiện của kháng nguyên rotavirus bởi EIA trong 50% đến 80% (tùy theo nghiên cứu) trẻ sơ sinh vào khoảng ngày thứ 7, và 24% vào khoảng ngày 30.
Sau liều thứ 2, sự phát hiện kháng nguyên của rotavirus đã được phát hiện trong 4% đến 18% trẻ sơ sinh vào khoảng ngày thứ 7 và 12% vào khoảng ngày 30. Khả năng lây truyền virus của vắc-xin đã được đánh giá trong một thử nghiệm lâm sàng giữa các cặp sinh đôi (với cặp sinh đôi được nhận vắc-xin và cặp còn lại không được nhận vắc-xin). Nghiên cứu này cho thấy bằng chứng về việc truyền chủng vắc-xin ở 19% các cặp song sinh chưa được tiêm chủng và chuyển đổi huyết thanh ở 21% các cặp song sinh chưa được tiêm chủng.
Tại Việt Nam, các nhà nghiên cứu đã phát triển vắc-xin Rotavin M1. Đây là loại vắc-xin sống giảm độc lực sử dụng ở dạng uống. Vắc-xin này được sản xuất trên thế bào thận khỉ. Mỗi liều có chứa 2ml vắc-xin chủng rotavirus G1P. Vắc-xin Rotavin M1 có ưu điểm là giá thành rẻ hơn các vắc-xin khác.
Bệnh viện Đa khoa Quốc tế Vinmec hiện đang cung cấp Chương trình tiêm chủng trọn gói với nhiều loại vắc-xin đa dạng cho các đối tượng khác nhau, từ trẻ sơ sinh, trẻ nhỏ, người lớn, phụ nữ trước và trong khi mang thai.
Để đăng ký tiêm phòng, Quý khách vui lòng liên hệ trực tiếp đến Hệ thống Y tế Vinmec trên toàn quốc hoặc đặt hẹn TẠI ĐÂY.
Nguồn tham khảo: cdc.gov; historyofvaccines.org