Tế bào gốc từ mô mỡ và ứng dụng lâm sàng trong y học tái tạo
Tế bào gốc từ mô mỡ đã được nghiên cứu rộng rãi và đầy tiềm năng trong y học tái tạo. Trong tương lai, tế bào gốc từ mô mỡ sẽ còn tiếp tục có nhiều nghiên cứu tiền lâm sàng, lâm sàng được thực hiện để xác định đặc tính sinh học cũng như mở rộng phạm vi ứng dụng trong lĩnh vực y học tái tạo.
1. Tế bào gốc từ mô mỡ là gì?
Tế bào gốc trung mô (MSC) là 1 ví dụ về mô hoặc tế bào gốc "trưởng thành". Các tế bào này là “đa năng”, chúng có thể tạo ra hơn 1 loại tế bào chuyên biệt của cơ thể, nhưng không phải tất cả. MSC tạo ra các tế bào chuyên biệt khác nhau được tìm thấy trong các mô xương. Ví dụ, chúng có thể biệt hóa hoặc chuyên biệt hóa thành tế bào sụn, tế bào xương (nguyên bào xương) và tế bào mỡ. Mỗi tế bào chuyên biệt này có hình dạng, cấu trúc, chức năng đặc trưng riêng và mỗi tế bào thuộc 1 mô cụ thể.
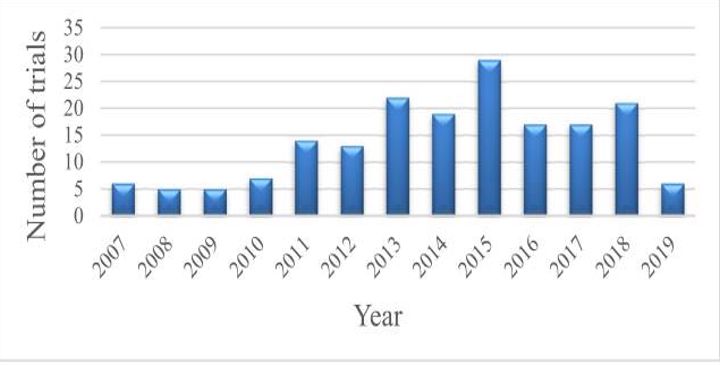
Tế bào gốc từ mô mỡ (ASC) được gọi là tế bào gốc đa năng, sử dụng phổ biến nhất trong các ứng dụng lâm sàng những năm gần đây. Mô mỡ (AT) có lợi thế trong việc thu hoạch, cô lập và nhân tế bào gốc từ mô mỡ, đặc biệt có 1 lượng tế bào gốc dồi dào so với tủy xương. Tế bào gốc từ mô mỡ có thể được tìm thấy trong các phân đoạn mạch đệm (SVF) dễ dàng thu được từ quá trình phân ly của mô mỡ. Cả phân đoạn mạch đệm (SVF) và tế bào gốc mô mỡ được nhân nuôi đều thể hiện các đặc điểm của tế bào gốc, như biệt hóa thành nhiều loại tế bào, tái tạo, điều hòa hệ miễn dịch. Do đó, phân đoạn mạch và tế bào gốc mô mỡ đã được nghiên cứu để đánh giá mức độ an toàn cũng như lợi ích cho việc sử dụng của con người. Trên thực tế, số lượng các thử nghiệm lâm sàng về tế bào gốc mô mỡ sẽ tăng lên theo năm, nhưng đều đang ở giai đoạn I, II; thiếu giai đoạn III và IV.
2. Vai trò của tế bào gốc từ mô mỡ
Các tế bào gốc từ mô mỡ có thể trực tiếp biệt hóa thành các dòng tế bào sừng, giống nguyên bào sợi và nội mô, cùng với việc giải phóng các yếu tố tăng trưởng và cytokine, tất cả đều thúc đẩy hình thành mạch, phát triển, di chuyển nguyên bào sợi, sản xuất fibronectin và collagen. Các kết quả này nhất quán trong 14 dữ liệu thử nghiệm lâm sàng (Clinicaltrial.gov). Các nghiên cứu cũng cho thấy, tế bào gốc mô mỡ cải thiện việc chữa lành các vết loét mãn tính và giảm đau.
Đặc biệt, tế bào gốc mô mỡ còn được ứng dụng trong y học như sau:
- Góp phần duy trì sự cân bằng của hệ thống miễn dịch bằng cách điều chỉnh tế bào T cũng như hoạt động và bài tiết IL-10.
- Tế bào gốc mô mỡ của con người rất an toàn để áp dụng vào việc điều trị các bệnh khác nhau trong nhiều năm.
- Một số trường hợp có thể được sử dụng trong y học tái tạo và điều hòa miễn dịch, bởi tế bào gốc mô mỡ có tiềm năng biệt hóa thành nhiều dòng tế bào, rất hữu ích cho việc sử dụng tái tạo.
- Được ứng dụng trong điều trị các bệnh liên quan đến tim và kỹ thuật mô. Liệu pháp tế bào gốc mô mỡ giúp tăng cường tái tạo mô cơ tim và cải thiện chức năng của chúng.
Đặc biệt, tế bào gốc mô mỡ có thể điều chỉnh hệ thống miễn dịch bằng khả năng chống viêm, hiệu quả đối với bệnh đa xơ cứng, viêm khớp dạng thấp và đái tháo đường. Tuy nhiên, 1 số thử nghiệm ngẫu nhiên có đối chứng đã báo cáo kết quả tích cực của việc sử dụng tiêm ASCs ở bệnh nhân thoái hóa khớp háng và gối mà không có tác dụng phụ. Một số thử nghiệm lâm sàng đáng chú ý như sau:
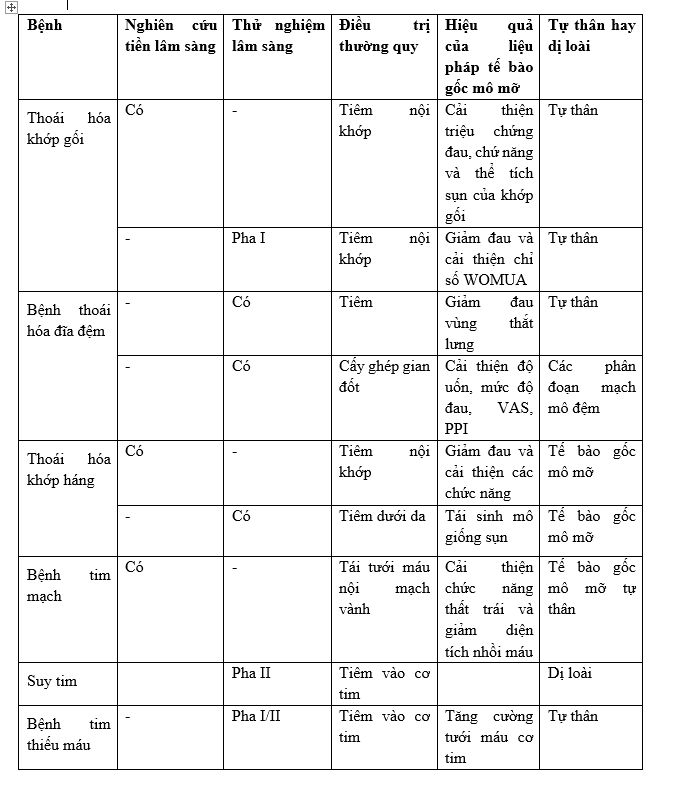
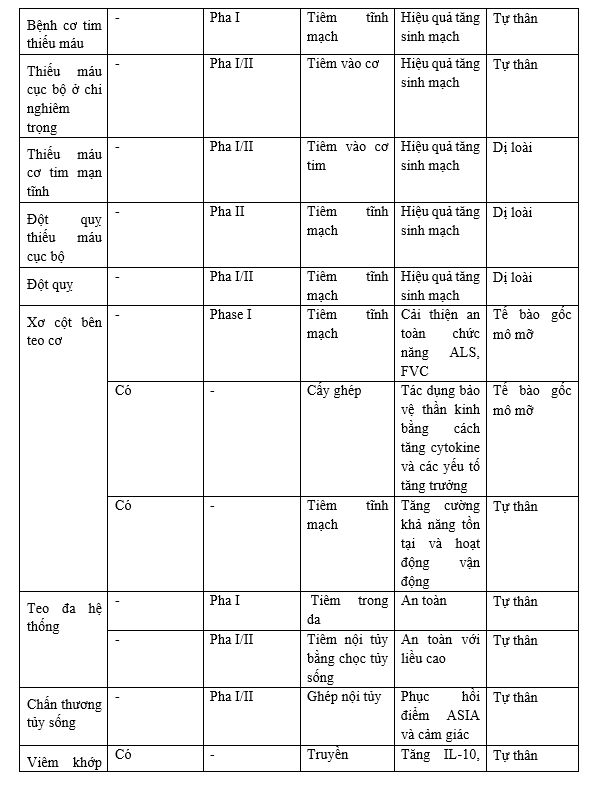
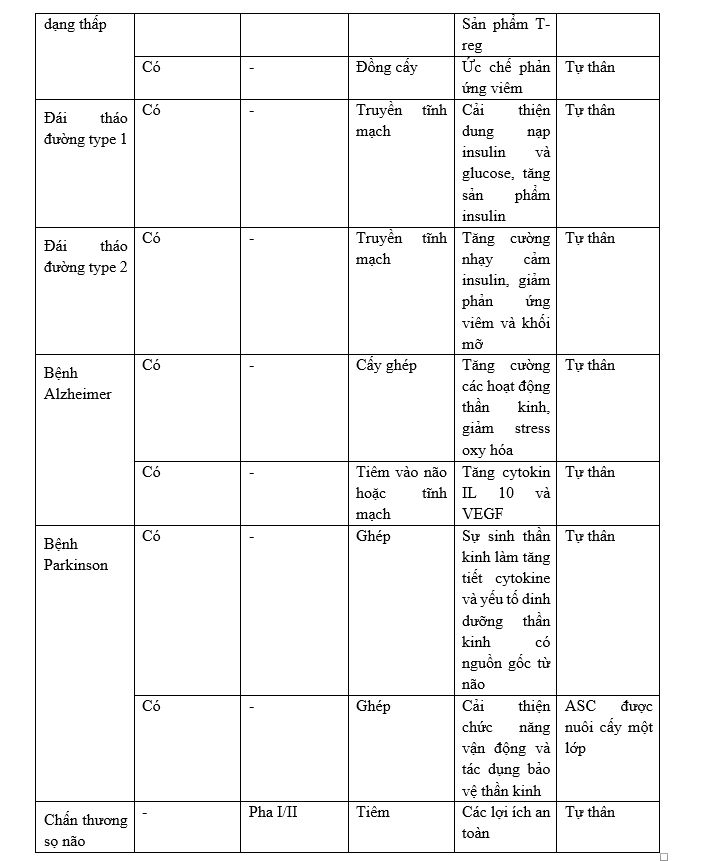
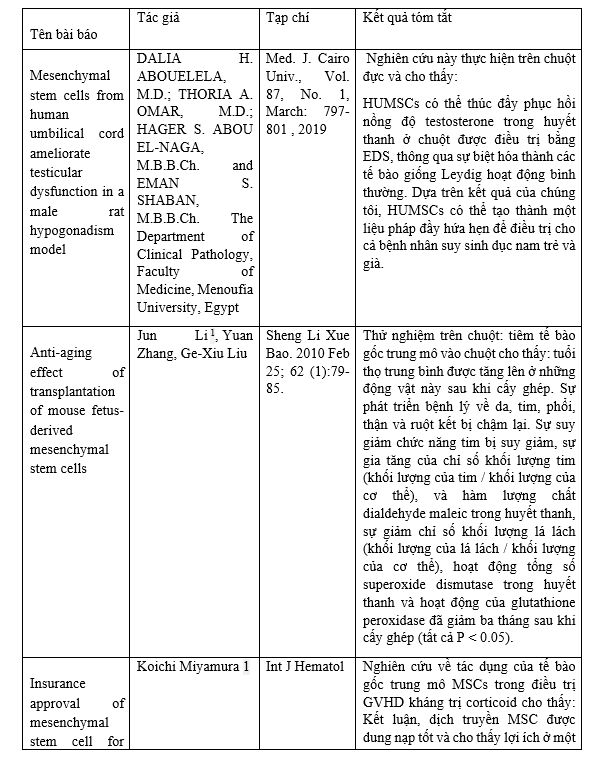
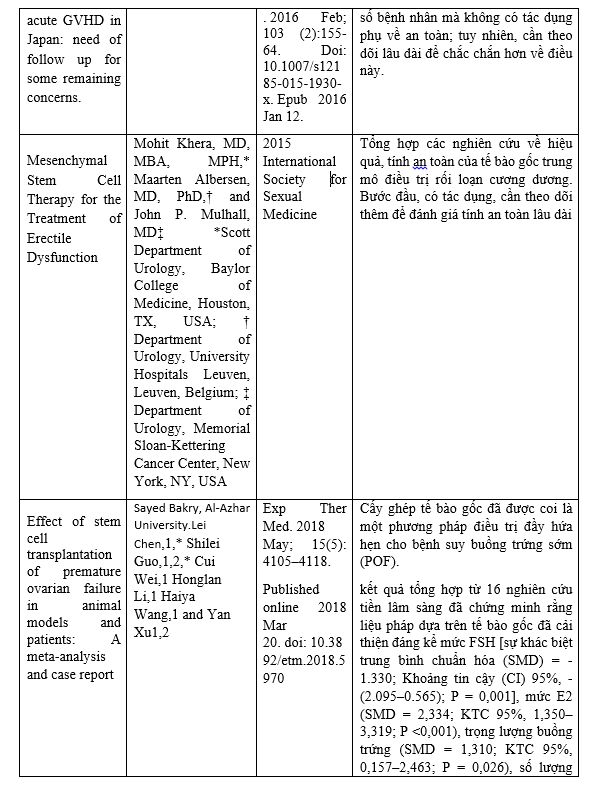
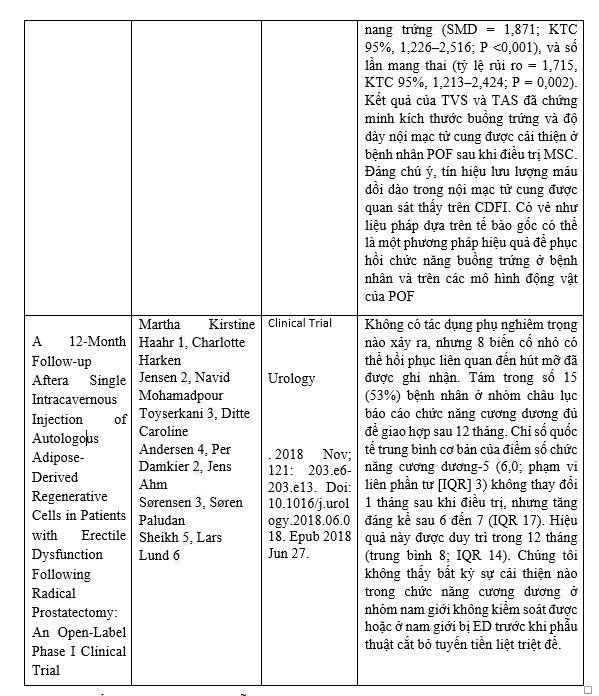
Một số nghiên cứu khác nổi bật liên quan tới ứng dụng liệu pháp tế bào gốc trung mô:
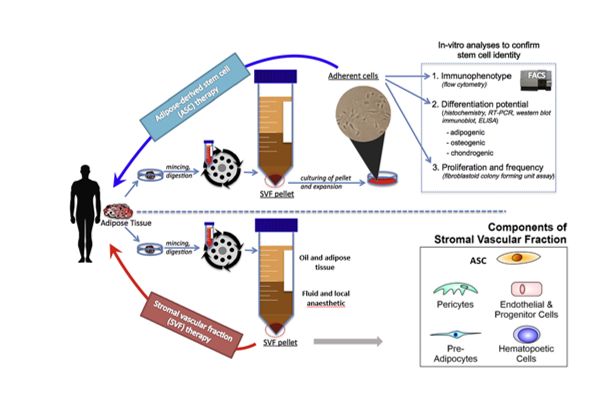
Mô mỡ có thể được thu thập 1 cách dễ dàng ở vùng bụng, sau khi trải qua quá trình phân giải bởi collagenase sẽ được chia thành 2 phần như sau:
- Tế bào mỡ.
- Phân đoạn tế bào tạo mạch nền (stromal vascular fraction - SVF).
Từ phân đoạn tế bào tạo mạch nền, các tế bào gốc từ mô mỡ (adipose-derived stem cells – ASC) sẽ được lựa chọn dựa trên đặc tính bám dính của chúng trong môi trường nuôi cấy. ASC có khả năng biệt hóa thành các tế bào mô mỡ, sụn và xương cũng như khả năng giảm viêm thông qua các hiệu ứng paracrine.
Về mặt ứng dụng, hiện nay cả phân đoạn tế bào tạo mạch nền và tế bào gốc từ mô mỡ đều đang được sử dụng trong các phòng khám cũng như thử nghiệm lâm sàng. Trong khi phân đoạn tế bào tạo mạch nền thường được sử dụng để tái tạo mô mềm thì tế bào gốc mô mỡ thường được nuôi cấy tăng sinh từ hàng triệu đến hàng trăm triệu tế bào để có thể đáp ứng cho các ứng dụng lâm sàng yêu cầu số lượng tế bào lớn hơn. Số lượng tế bào gốc từ mô mỡ cần thiết sẽ được tính dựa trên liều sử dụng, đường truyền, loại bệnh điều trị và đặc biệt là kích thước của vùng bị tổn thương.
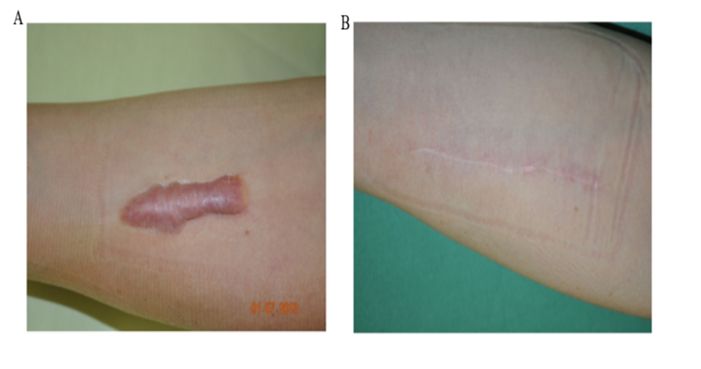
Tính đến tháng 3/2021, đã có tổng cộng 122 thử nghiệm lâm sàng sử dụng tế bào gốc mô mỡ trong điều trị các bệnh về da và mô liên kết, tim và máu, thần kinh và dinh dưỡng cũng như chuyển hóa được đăng ký trên trang “www.clinicaltrials.gov”. Ví dụ, tế bào gốc từ mô mỡ tự thân đã được sử dụng để điều trị trên 8 bệnh nhân phẫu thuật tái tạo sẹo tại Khoa Bỏng và Phẫu thuật Tái tạo của Bệnh viện Đại học ở Bratislava, kết quả cho thấy sau 6 tháng điều trị điểm VSS (thang điểm sẹo Vancouver- VSS) trung bình từ 7,88 trước điều trị giảm xuống còn 2,34 điểm. Kết quả thu được đã chứng minh cho khả năng tái tạo sẹo sau phẫu thuật của tế bào gốc từ mô mỡ.
Ngoài ra, tế bào gốc từ mô mỡ tự thân cũng cho thấy hiệu quả trong việc điều trị bệnh thoái hóa khớp. Trong 1 thử nghiệm lâm sàng mù đôi, phân nhóm ngẫu nhiên pha IIb, Lee và cộng sự đã chứng minh được rằng, tế bào gốc tự thân từ mô mỡ giúp cải thiện chức năng và giảm đau cho 12 bệnh nhân bị viêm khớp gối mà không gây ra tác dụng phụ so với nhóm đối chứng được tiêm nước muối bình thường. Đặc biệt, tế bào gốc từ mô mỡ cũng là 1 trong các dòng tế bào có khả năng tiết ra thể tiết hay các túi ngoại bào (extracellular vesicles – EVs), đầy tiềm năng ứng dụng trong y học tái tạo và lĩnh vực làm lành vết thương.
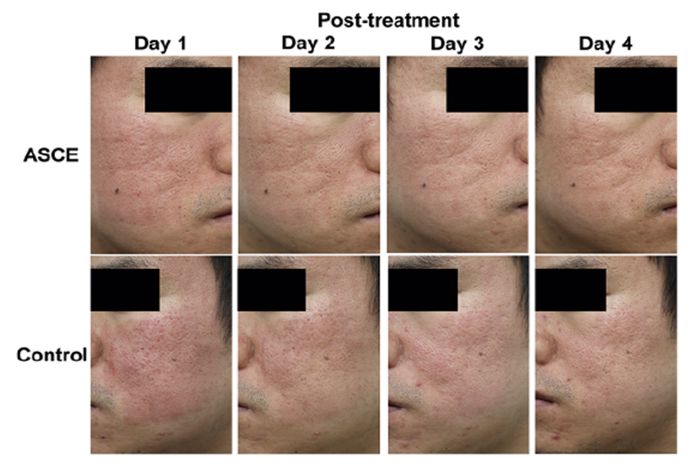
EVs từ tế bào gốc mô mỡ đã được chứng minh có tác động đến quá trình hình thành mạch, khả năng sống và chết của tế bào, sự viêm nhiễm, tái tạo mô cũng như làm giảm tình trạng bệnh lý. Kwon và các cộng sự đã sử dụng thể tiết từ tế bào gốc mô mỡ nhằm bổ trợ sau khi áp dụng phương pháp laser CO2 phân đoạn để điều trị sẹo mụn trong vòng 12 tuần cho 25 bệnh nhân. Kết quả cho thấy, điều trị bằng phương pháp laser CO2 phân đoạn kết hợp với thể tiết từ mô mỡ làm tăng hiệu quả điều trị hơn so với việc không sử dụng chúng (giảm số điểm đánh giá sẹo mụn ECCA - échelle d’évaluation clinique des cicatrices d’acné scores - là 32.5% so với 19,9%; giảm tỉ lệ ban đỏ cũng như thời gian điều trị).
Nói chung trong hơn 20 năm qua, mô mỡ và tế bào gốc từ mô mỡ đã được nghiên cứu rộng rãi như 1 nguồn tế bào đầy tiềm năng cho kỹ thuật mô và y học tái tạo. Trong tương lai sẽ còn tiếp tục có nhiều nghiên cứu tiền lâm sàng, lâm sàng được thực hiện nhằm xác định đặc tính sinh học, mở rộng phạm vi ứng dụng của tế bào mô mỡ trong lĩnh vực y học tái tạo.
3. Vinmec nghiên cứu và ứng dụng liệu pháp tế bào gốc từ mô mỡ trong điều trị bệnh mãn tính
Bắt kịp xu thế, Vinmec là 1 trong những đơn vị tiên phong tại Việt Nam về nghiên cứu, ứng dụng liệu pháp tế bào gốc trong điều trị các bệnh lý mạn tĩnh chưa có phương pháp điều trị hiệu quả. 1 trong loại tế bào gốc được nghiên cứu và ứng dụng tại Vinmec đó là tế bào gốc trung mô từ mô mỡ tự thân.
Năm 2014, Vinmec nghiên cứu sử dụng tế bào gốc mô mỡ điều trị thoái hóa khớp và chấn thương cột sống. Đến 2017, thực hiện thử nghiệm lâm sàng nhãn mở: “Thử nghiệm lâm sàng nhãn mở, đơn nhóm, đánh giá an toàn và hiệu quả của liệu pháp ứng dụng tế bào gốc trung mô từ mô mỡ để điều trị suy giảm nội tiết tố sinh dục sớm ở đối tượng trung niên”.
Nghiên cứu đã hoàn thành thu thập số liệu tổng kết và bước đầu cho thấy tính hiệu quả và an toàn của liệu pháp điều trị. Ưu thế và công nghệ của Vinmec bao gồm:
- Vinmec đã làm chủ hoàn toàn công nghệ phân lập, nuôi cấy tế bào gốc từ mô mỡ. Tế bào gốc được nuôi cấy trong hệ thống phòng sạch đạt tiêu chuẩn ISO 14644-1 (Class 6, class 7 và class 8); đảm bảo môi trường vô trùng tuyệt đối cho việc phân lập, xử lý, nuôi cấy tế bào gốc. Tế bào gốc khi nuôi cấy được kiểm chuẩn bằng hệ thống xét nghiệm đảm chất lượng theo tiêu chuẩn quốc tế.
- Ngoài ra, Vinmec có hệ thống Ngân hàng sinh học hiện đại đạt tiêu chuẩn quốc tế, lưu trữ tế bào gốc trung mô từ mô mỡ. Do vậy, có thể lưu trữ để sử dụng cho lần điều trị tiếp theo mà không phải thực hiện thủ thuật thu thập mô mỡ, giúp giảm giá thành và nguy cơ cho khách hàng.
Tóm lại, tế bào gốc mô mỡ sẽ còn tiếp tục có nhiều nghiên cứu tiền lâm sàng, lâm sàng được thực hiện để xác định đặc tính sinh học cũng như mở rộng phạm vi ứng dụng trong lĩnh vực y học tái tạo.
Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.
Tài liệu tham khảo:
- Patricia A. Zuk MZ, Hiroshi Mizuno, Jerry Huang, J. William Futrell, Adam J. Katz, Prosper Benhaim, H. Peter Lorenz, Marc H. Hedrick. Multilineage Cells from Human Adipose Tissue: Implications for Cell-Based Therapies. Tissue Engineering. 2001;7(2):211-28.
- Zuk PA, Zhu M, Ashjian P, Ugarte DAD, Huang JI, Mizuno H, et al. Human Adipose Tissue Is a Source of Multipotent Stem Cells. Molecular biology of the cell. 2002;13(12):4279-95.
- Patrikoski M, Mannerstrom B, Miettinen S. Perspectives for Clinical Translation of Adipose Stromal/Stem Cells. 2019;2019:5858247.
- Laloze J, Varin A, Bertheuil N, Grolleau JL, Vaysse C, Chaput B. Cell-assisted lipotransfer: Current concepts. Annales de Chirurgie Plastique Esthétique. 2017;62(6):609-16.
- Garcia-Olmo D, Herreros D, Pascual I, Pascual JA, Del-Valle E, Zorrilla J, et al. Expanded adipose-derived stem cells for the treatment of complex perianal fistula: a phase II clinical trial. Diseases of the colon and rectum. 2009;52(1):79-86.
- Zahorec P, Sarkozyova N, Ferancikova N, Bukovcan P, Danisovic L, Bohac M, et al. Autologous mesenchymal stem cells application in post-burn scars treatment: a preliminary study. Cell and tissue banking. 2021;22(1):39-46.
- Lee WS, Kim HJ, Kim KI. Intra-Articular Injection of Autologous Adipose Tissue-Derived Mesenchymal Stem Cells for the Treatment of Knee Osteoarthritis: A Phase IIb, Randomized, Placebo-Controlled Clinical Trial. 2019;8(6):504-11.
- Wong DE, Banyard DA, Santos PJF, Sayadi LR, Evans GRD, Widgerow AD. Adipose-derived stem cell extracellular vesicles: A systematic review(✰). Journal of plastic, reconstructive & aesthetic surgery : JPRAS. 2019;72(7):1207-18.
- Kwon HH, Yang SH, Lee J, Park BC, Park KY, Jung JY, et al. Combination Treatment with Human Adipose Tissue Stem Cell-derived Exosomes and Fractional CO2 Laser for Acne Scars: A 12-week Prospective, Double-blind, Randomized, Split-face Study. Acta dermato-venereologica. 2020;100(18):adv00310.
- Gimble JM, Guilak F. Adipose-derived adult stem cells: isolation, characterization, and differentiation potential. Cytotherapy. 2003;5(5):362-9.
- Lindroos B, Suuronen R, Miettinen S. The Potential of Adipose Stem Cells in Regenerative Medicine. Stem Cell Reviews and Reports. 2011;7(2):269-91.
- Oedayrajsingh-Varma MJ, van Ham SM, Knippenberg M, Helder MN, Klein-Nulend J, Schouten TE, et al. Adipose tissue-derived mesenchymal stem cell yield and growth characteristics are affected by the tissue-harvesting procedure. Cytotherapy. 2006;8(2):166-77.
- Mesenchymal stem cells: the "other" bone marrow stem cells; https://www.eurostemcell.org/mesenchymal-stem-cells-other-bone-marrow-stem-cells.
- Lalu M.M., McIntyre L., Pugliese C., Fergusson D., Winston B.W., Marshall J.C., Granton J., Stewart D.J. Safety of cell therapy with mesenchymal stromal cells (SafeCell): a systematic review and meta-analysis of clinical trials. PLoS ONE. 2012;7:e47559. doi: 10.1371/journal.pone.0047559. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
- Joo H.J., Kim J.-H., Hong S.J. Adipose Tissue-Derived Stem Cells for Myocardial Regeneration. Korean Circ. J. 2017;47:151–159. doi: 10.4070/kcj.2016.0207. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
- Bai X., Yan Y., Song Y.-H., Seidensticker M., Rabinovich B., Metzele R., Bankson J.A., Vykoukal D., Alt E. Both cultured and freshly isolated adipose tissue-derived stem cells enhance cardiac function after acute myocardial infarction. Eur. Heart J. 2009;31:489–501. doi: 10.1093/eurheartj/ehp568. [PubMed] [CrossRef] [Google Scholar].
- Haenel A., Ghosn M., Karimi T., Vykoukal J., Kettlun C., Shah D., Dave A., Valderrabano M., Schulz D., Azares A. Unmodified, autologous adipose-derived regenerative cells improve cardiac function, structure and revascularization in a porcine model of chronic myocardial infarction. bioRxiv. 2018 doi: 10.1101/286468. [CrossRef] [Google Scholar].
- Park M.-J., Kwok S.-K., Lee S.-H., Kim E.-K., Park S.-H., Cho M.-L. Adipose tissue-derived mesenchymal stem cells induce expansion of interleukin-10-producing regulatory B cells and ameliorate autoimmunity in a murine model of systemic lupus erythematosus. Cell Transplant. 2015;24:2367–2377. doi: 10.3727/096368914X685645. [PubMed] [CrossRef] [Google Scholar].
- Dall’Oca C., Breda S., Elena N., Valentini R., Samaila E.M., Magnan B. Mesenchymal Stem Cells injection in hip osteoarthritis: Preliminary results. Acta Bio-Med. Atenei Parm. 2019;90:75–80. [PMC free article] [PubMed] [Google Scholar].
- Jones I.A., Wilson M., Togashi R., Han B., Mircheff A.K., Vangsness C.T., Jr. A randomized, controlled study to evaluate the efficacy of intra-articular, autologous adipose tissue injections for the treatment of mild-to-moderate knee osteoarthritis compared to hyaluronic acid: A study protocol. BMC Musculoskelet. Disord. 2018;19:383. doi: 10.1186/s12891-018-2300-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
- Lee W.-S., Kim H.J., Kim K.-I., Kim G.B., Jin W. Intra-Articular Injection of Autologous Adipose Tissue-Derived Mesenchymal Stem Cells for the Treatment of Knee Osteoarthritis: A Phase IIb, Randomized, Placebo-Controlled Clinical Trial. Stem Cells Transl. Med. 2019 doi: 10.1002/sctm.18-0122. [PMC free article] [PubMed] [CrossRef] [Google Scholar].
- Roato I., Belisario D.C., Compagno M., Lena A., Bistolfi A., Maccari L., Mussano F., Genova T., Godio L., Perale G. Concentrated adipose tissue infusion for the treatment of knee osteoarthritis: Clinical and histological observations. Int. Orthop. 2019;43:15–23. doi: 10.1007/s00264-018-4192-4. [PubMed] [CrossRef] [Google Scholar].
- Adipose Tissue Stem Cells for Therapy: An Update on the Progress of Isolation, Culture, Storage, and Clinical Application. J Clin Med. 2019 Jul; 8(7): 917. Published online 2019 Jun 26. doi: 10.3390/jcm8070917.